[Chemie] Wann sind Isotope radioaktiv?
Guten Tag,
ich benötige noch ein bisschen Hilfe, um erkennen zu können, in welchen Fällen Isotope radioaktiv sind. Ich freue mich sehr auf eure hilfreichen und ausführlichen Antworten.
C-14 ist radioaktiv, wodurch mithilfe der Halbwertszeit eine Altersbestimmung bei Fossilien möglich ist, was man als Radiokarbonmethode bezeichnet.
Aber wieso ist nun das Isotop C-14 radioaktiv? C-14 hat ja 6 Protonen und 8 Neutronen. Gibt es da eine allgemeine Regel, wie man das erkennen kann, wann ein Isotop radioaktiv ist?
Ich dachte mir, dass es eventuell an der Anzahl von den Protonen und Neutronen liegen kann. Vielleicht immer dann, wenn die Zahl der Protonen und Neutronen ungleich ist. Aber so scheint es nicht zu sein, denn im Internet habe ich folgendes gefunden:

Denn C-13 hat ja 6 Protonen und 7 Neutronen. Aber C-13 ist ja anscheinend nicht radioaktiv. Woran lässt sich also nun erkennen, ob ein Isotop radioaktiv ist, oder nicht?
5 Antworten
Leider erstmal gar nicht. Das ist relativ komplex, eine einfache Regel gibt es da nicht.
Wenn das Atom energetisch stabil ist, dann ist es stabil. Ob ein Atom stabil ist oder nicht kann man aber nicht per hinsehen oder handauflegen sagen (ausser es ist völlig eskaliert), das muss man schon berechnen.
Näherungsweise kannst du die Bethe-Weizsäcker-Formel dazu benutzen (welche für die meisten Atome ganz gut klappt). Die ist ziemlich einfach, du musst nur einsetzten. Hier aus Wikipedia kopiert:

Es wirklich halbewgs genau zu berechnen ist hingegen nicht trivial und mal nicht so nebenbei gemacht.
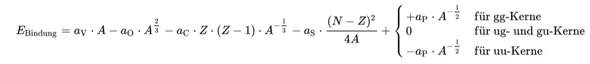
Ich sagte doch näherungsweise. Wenn die Bindungsenergie nicht positiv ist, weiß man schon mal dass der Kern nicht stabil ist. Und wenn die Bindungsenergie sehr hoch ist kann man mit hoher Wahrscheinlichkeit von einen stabilen Kern ausgehen.
Dass das nur eine grobe Näherung bzw. ein Indiz ist und keine exakte Berechnung habe ich, dachte ich, doch mehr als deutlich gemacht. Aber gut, dann weißt du halt auch nochmal drauf hin...
Im Prinzip stimmt das schon. Kerne mit ausgewogenem Protonen-Neutronen-Verhältnis sind stabil, bei schwereren Kernen mit etwas Neutronenüberschuss wegen der zunehmenden Abstoßung zwischen den Protonen. Dann kommt allerdings auch der Alpha-Zerfall ins Spiel, der sich ab einer gewissen Schwere (Massenzahl ca. 170) energetisch lohnt. Je größer die Entfernung von der Stabilität, desto wahrscheinlicher die Radioaktivität. C-13 geht halt grad noch durch. Beim Zinn gehen sogar 10 stabile Isotope durch. Es sind schon noch ein paar andere Faktoren für die Stabilität maßgeblich: Oberfl./Vol.-Verhältnis des Kerns, gerade od. ungerade Anzahl von Protonen und Neutronen ("Paarungsmöglichkeit"), deren jeweilige Gesamtzahl ("magische Zahlen" = besonders stabil) u.a.m.
Warum Dinge radioaktiv sind, ist ein sehr komplexes Thema der Quantenphysik. Wenn du da Interesse hast, ich kenne ein Video dass das ganze sehr gut erklärt.
https://www.youtube.com/watch?v=mqgmKzRneic
Generell kannst du aber immer auf einer radionuklidkarte, das ist sowas wie ein erweitertes Periodensystem wo auch alle Isotope der Elemente enthalten sind, nachschauen, welche Isotope radioaktiv sind und welche nicht.
Dafür verwendet man z.B. die Karlsruher Nuklidkarte. Da steht drauf welche Isotope wie zerfallen.
Ich wüsste nicht, dass man durch das Verhältnis zwischen Protonen und Neutronen eine sichere Aussage treffen kann, ob ein Isotop radioaktiv ist.
Mit der Bethe-Weizsäcker-Formel kann man näherungsweise die Masse eines Atoms /Atomkerns berechnen und damit die Bindungsenergie, aber durch Einsetzen alleine bekommst Du nicht raus, ob ein Kern stabil ist (dass die Bindungsenergie positiv ist, genügt nicht).