Chemie-Blausäure?
- Wie kommt man auf den Namen von HCN? Weil es eine Säure ist und nicht die Benennung von Molekülen?
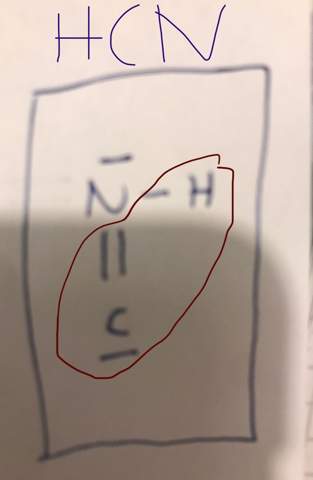
- Warum ist mein Abbild falsch? Die Oktettregel ist doch erfüllt (siehe rot markiert)?
Danke
3 Antworten
Deine Formel ist kaputt, weil H–N̄=C| am C nur ein Elektronensextett hat. Richtig wäre H–N≡C| (also das freie Elektronenpaar am N zur Bindung benutzen), und wenn man es ganz richtig machen will, dann kommen noch Formalladungen dazu: H–N⁺≡C⁻|
Leider ist das aber immer noch nicht Blausäure, sondern Isoblausäure. Die richtige Blausäure hat die Struktur H–C≡N| und Du siehst, daß man hier keine Formalladungen braucht. Das läßt vermuten, daß Blausäure die stabilere Form ist.
Isoblausäure kann man nicht als Substanz herstellen, weil es keine Möglichkeit gibt, das H daran zu hindern, vom C zum N zu wandern, da Isoblausäure ja eine Säure ist, also ein H⁺ abgeben kann, und das sucht sich dann ein CN⁻ und bindet fast immer an den Kohlenstoff. In realer Blausäure wandeln sich die beiden Formen also ständig ineinander um. Man kann Isoblausäure nur als Gas bei sehr geringem Druck stabil halten, weil dann mangels Reaktionspartner kein H⁺ abgegeben werden kann. Im Labor schafft man so geringe Drücke kaum, aber Isoblausäure ist schon im interstellaren Gas gefunden worden.
Man kann das, was ich im vorigen Absatz erklärt habe, auch äquivalent anders sagen: HCN und HNC sind zwei schwache Säuren mit dem Cyanid-Ion als gemeinsamer konjugierter Base, aber HNC ist die stärkere Säure. Daher nimmt das Cyanid CN⁻ ein H⁺ lieber am C als am N an, und das Gleichgewicht liegt weit auf der Blausäureseite.
Wenn man das H durch irgendetwas anderes ersetzt, z.B. einen organischen Rest, dann kann das Zeug nicht mehr wandern. Deshalb gibt es z.B. sowohl Methylcyanid (Acetonitrl) CH₃–C≡N als auch das wesentlich exotischere (und giftigere) Methylisocyanid CH₃–N≡C.
Das Stickstoffatom hängt am Kohlenstoffatom mit einer Dreifachbindung. Das Wasserstoffatom hängt zusätzlich mit einem Bindungsärmchen am Kohlenstoffatom. Somit ist an der Außenschale des Kohlenstoffatoms alle Bindungen besetzt.
Durch die Dreifachbindung hat das HCN-Molekül die unangenehme Eigenschaft am Hämoglobin anzudocken- die Dreifachbindung wird aufgehoben- es bildet sich Methhämoglobin das am Gasaustausch nicht mehr teilnehmen kann, es kommt zu einer inneren Erstickung.
LA
Zur Namensgebung kann ich leider nicht hilfreich sein.
Aber die Oktettregel ist zumindest bei Kohlenstoff nicht erfüllt.
Durch die Doppelbindung hat es 4 Außenelktronen, plus die zwei als Strich eingezeichneten. Das macht 6, es brauch aber 8.
Du musst noch einen zweiten Strich dazu machen.
Man braucht nur das freie Elektronenpaar des N-Atoms zum bindenden machen. Dann hat man die (lineare) "Iso-Blausäure": H-N≡C. Diese ist aber nicht stabil, denn das N-Atom ist sauerer als das C-Atom, sodass sie sich zu Blausäure umlagert.