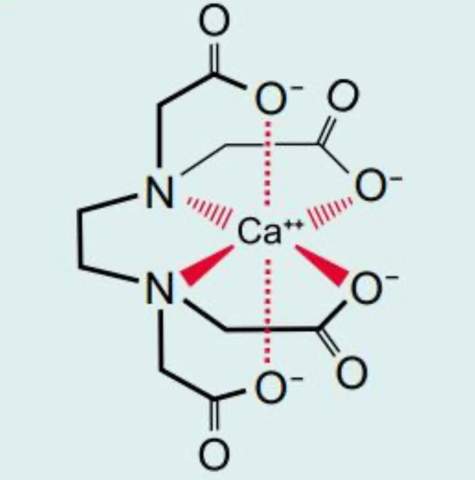
Chelatkomplex Chemie?
Hey eine Verständnisfrage, wieso ist der Sauerstoff negativ geladen? Wie ist dort die Elektronenverteilung?
Vielen Dank schonmal im voraus!!
3 Antworten
Naja, das sind Carboxygruppen, die geben nun mal ihre Protonen ab in wässriger Lösung, ergo bleib ein negativ geladenes O übrig. Und was meinst mit Elektronenverteilung "dort"? Am O? Das hat formal dann 3 freie Elektronenpaare wie bei jeder anderen deprotonierten Carbonsäure auch.
Die Sauerstoffatome sind eine ehemalige Carboxylgruppe R-COOH, die ein Proton abgegeben hat. Nicht anders als wenn Essigsäure zum Acetation wird.
Das "A" in ETDA bedeutet ja auch "Acetat".
Die negative Ladung ist über die beiden O-Atome verteilt, auch wie beim Acetat.
Moin,
der Sauerstoff ist negativ geladen, weil er Bestandteil einer funktionellen Gruppe, nämlich des Carboxylat-Ions, ist.
Das Carboxylat-Ion stammt seinerseits ursprünglich aus einer Carboxygruppe (der Carbonsäuregruppe –COOH). Wenn die saure Carboxygruppe (früher Carboxylgruppe) ein Proton abspaltet, wird aus ihr die Carboxylatgruppe:
R–COOH ---> R–COO– + H+
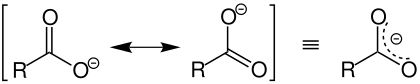
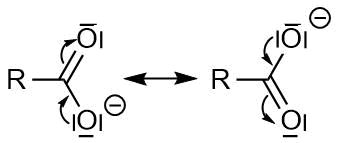
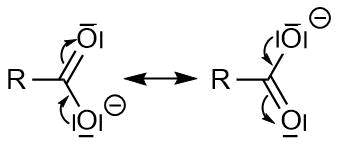
Die Elektronenverteilung ist komplizierter zu beschreiben. Die Carboxylatgruppe ist mesomeriestabilisiert. Formal bilden sich zwei Grenzstrukturen aus (siehe linke Seite der folgenden Abbildung), so dass sich die negative Ladung zwischen den beiden Sauerstoffatomen verteilt (siehe rechte Seite der folgenden Abbildung):
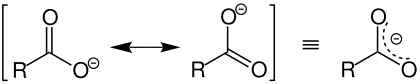
Jedes Sauerstoffatom hat dabei formal acht Valenzelektronen:
Alles klar?
LG von der Waterkant