warum verdunstet Aceton schneller als Ethanol und Wasser?
Hallo zusammen,
ich versuche gerade meine Chemie Hausaufgaben zu erledigen, ich komme aber absolut nicht weiter. In einem Versuch werden die Verdunstungsgeschwindigkeiten von Aceton, Wasser und Ethanol verglichen. Hierbei kommt raus, dass Aceton am schnellsten brauch, danach Ethanol und das Wasser verdunstet erst nach längerer Zeit. Aber warum? Wir sollen das irgendwie anhand der Zwischenmolekularen Wechselwirkungen erklären.
brauche dringend Hilfe :((
4 Antworten
Das Ganze ist, wie bereits in der Aufgabenstellung erwähnt, auf die intermolekularen (inter = zwischen) Wechselwirkungen zwischen den einzelnen Molekülen zurückzuführen. Zwischen zwei Wassermolekülen liegen dabei sehr starke Wasserstoffbrücken vor, wobei das Sauerstoffatom des Wassermoleküls zweimal eine negative Partialladung besitzt.
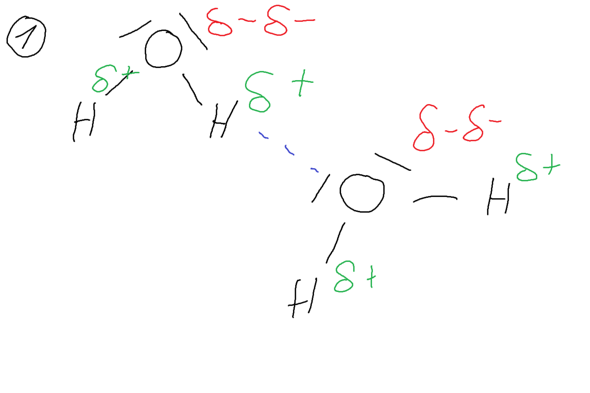
Das Ethanolmolekül besitzt hingegen ein Sauerstoffatom, welches nur eine einfache negative Partialladung besitzt. Es liegen zwar zwischen den einzelnen Ethanolmolekülen Waserstoffbrücken vor, diese sind aber nicht so stark wie die Wasserstoffbrücken zwischen den einzelnen Wassermolekülen.
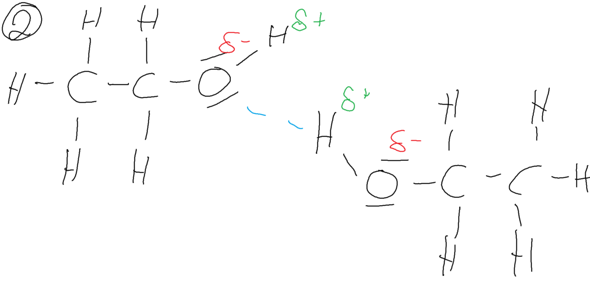
Zwischen Acetonmolekülen liegen keine Wasserstoffbrücken vor sondern lediglich "normale" Dipol-Dipol-Kräfte, die schwächer sind als die Wasserstoffbrücken. Die Dipol-Dipol-Kräfte werden zwischen dem Kohlenstoffatom und dem Sauerstoffatom der Carbonylgruppe ausgebildet.
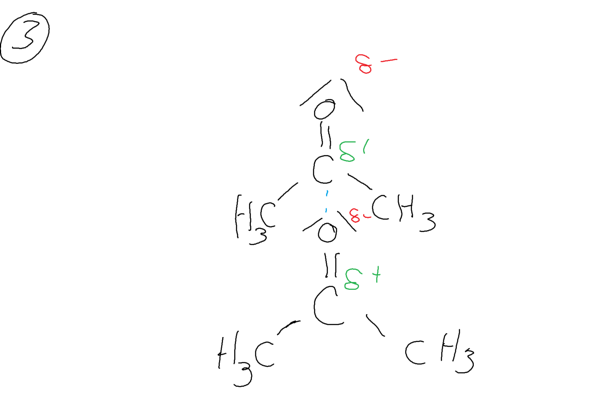
Das sind die Gründe dafür, weswegen Aceton schneller verdunstet als Ethanol und weswegen Ethanol schneller verdunstet als Wasser.
~Johannes
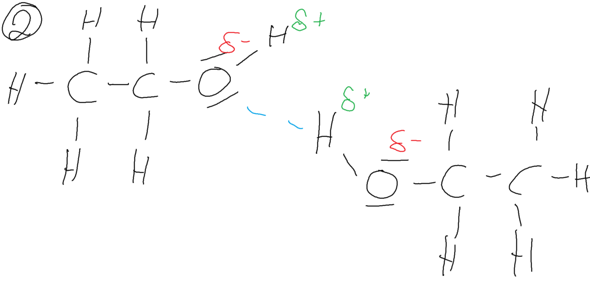
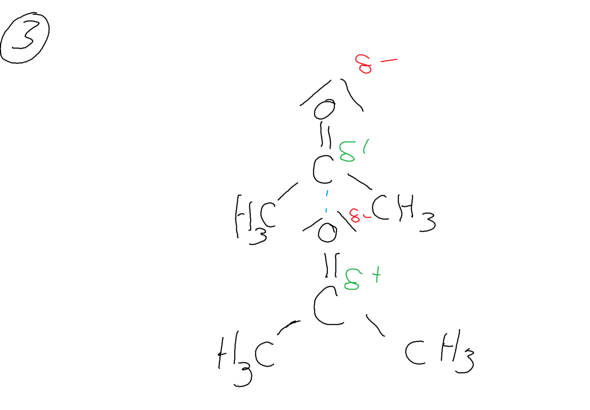
Du hast ja schon den Tipp bekommen, dir die zwischenmolekularen Wechselwirkungen anzugucken. Genau darin liegt der Grund, denn bei Wasser und Ethanol hast du die sog. Wasserstoffbrückenbindungen, die starke Wechselwirkungen zwischen den Molekülen mit sich bringen. Diese Wasserstoffbrückenbindungen gibt es im Aceton Molekül nicht, da an der Keto-Gruppe natürlich kein Wasserstoff hängt.
https://de.wikipedia.org/wiki/Wasserstoffbr%C3%BCckenbindung
da hängt mit der Bindungsenergie zusammen. Ethanol hat eine Siedetemperatur von ca. 78°C und Wasser hat 100°C. Wasser besitzt starke Wasserstoffbrücken und benötigt daher mehr Startenergie zum sieden.
Aceton =56 °C
Beim Aceton ist es dasselbe Prinzip
Aceton =Keton
Ethanol =Alkanol
Es spielen natürlich deine Zwischenmolekularen Wechselwirkungen eine wichtige Rolle da diese mit der Polarität zusammenhängen
Ethanol C-C Bindung und C-OH Gruppe
Im Keton gibt es Die OH Gruppe nicht mehr (sekundärer Alkohol würde oxidiert)
Dann vergleiche mal die zwischenmolekularen Kräfte innerhalb dieser drei Stoffe. Fällt Dir etwas auf? Welche liegen vor?