Valenzstrichformel Ozon?
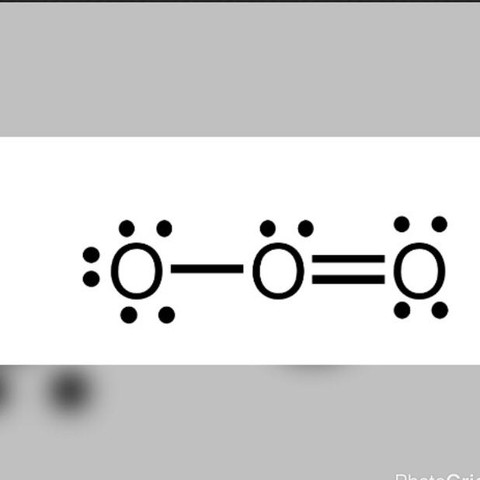
Ich bin am erstellen der Valentstrichformel von O3 gescheitert, habe dann diese gefunden, die für mich aber keinen Sinn ergibt: das linke O hätte laut dem Bild 7 Valenzelektronen. Außerdem dachte ich (auf den mittleren Sauerstoff bezogen) O geht nur 2 Bindungen ein. Kann mir das jemand erklären?
4 Antworten
hey hey ^^
ich kanns ja mal versuchen ^^.
das ist ja die Lewis schreibweise und in dieser befinden sich kovalente bindungen (atombindungen)
das ganz linke O hat doch keine 7 Valenzelektronen, man siehst doch die 6 punkte (e-) drumrum + noch 2 e- von dem mitleren O. diese Einfachbindung von mitte nach links gibt so wohl dem linken als auch dem mitleren O 2e- sie teilen sich die elektronen (kovalente bindung)
genau so wie in der mitte und ganz recht kommt man auch auf 8e- ^^
somit wurde bei jedem O die Edelgaskonfiguration erreicht.
Das ist eine "koordinative Bindung", die mit den gewöhnlichen Valenzbindungen, die man in der Schule kennenlernt, nicht erklärt werden kann.
Das linke O-Atom hat in dieser Formel eine positive Formalladung, das mittlere eine negative.
Es gibt auch die "Grenzformeln" mit 2 Einfachbindungen, je 1 positive Formalladung an den äußeren und 2 negative Formalladung am mittleren O-Atom und die mit 2 Doppelbindungen sowie natürlich die spiegelsymmetrische Formel zu dieser Formel hier.
Die "Wahrheit" liegt irgendwo zwischen diesen Grenzformeln; das nennt sich "Mesomerie" https://de.wikipedia.org/wiki/Mesomerie).
Naja, koordinativ würde ich das nicht unbedingt nennen.
Denn Koordinative Bindungen sind zb eher in Komplexen vorhanden, ich würde das eher als mesomere Grenzstruktur bezeichnen, wie weiter unten erwähnt ;)
Bei der Lewisformel unterscheidet man:
a) Elektronen, die ein Atom in der Valenzschale hat
b) Elektronen, die für Formalladungen gezählt werden
Am Beispiel des linken O´s:
a) freie und die gesamten bindenden werden einem Atom zugerechnet, macht hier 6 freie und ein bindendes also 8 (Oktettregel erfüllt)
b) freie ganz gezählt, bindendes geteilt, macht 7, also 1 mehr als beim Einzelatom---> Formalladung also -1
Daß diese Formalladungen nur "formal" sind liegt daran, daß nach einer Darstellungsmöglichkeit (VB-Methode) Bindungen oszillieren=Hin-und Herklappen können=Mesomerie oder Resonanz.
Ergänzung: das mittlere hat formal 5 Elektronen also 1 pos. Formalladung, das rechte hat 6, daher ungeladen. Alle haben aber die Achterschale.
Man kann nun die El. so umklappen, daß das rechte die neg. Ladung kriegt, das linke also neutral wird, das mittlere muß mit seiner pos. Ladung leben.
Man stellt sichvor, daß dies tatsächlich passiert. Immer wenn so was möglich ist, Elektronen also einen größeren "Auslauf" haben (Mesomerie), macht das das Teil etwas stabiler (hier nicht so sehr, aber besser als nichts)
Da ich schon gefühlte 99 Jahre aus dem Laden draußen bin: keine Ahnung!
Hallo, ja das ist schon richtig so.
Das mittlere O ist positiv geladen und das linke O ist somit negativ geladen. Also gleicht sich das im Mittel wieder aus.
Da jedes O neben 2 Bindungen noch 2 Valenzelektronenpaare hat, können diese natürlich auch zur Bindung beitragen.
Vielen Dank! Aber das geht doch über das, was man in der 10 klasse macht hinaus oder?