Thymolblau?
Wieso geht Thymolblau von Rot über gelb nach Blau?
Warum ist das Gelb zwischen? sollte durch die Deprotonierung der Hydroxygruppen nicht der Bathochrome Effekt verstärkt werden, sodass sich die absorbierte Wellenlänge in den längerwelligen Bereich verschiebt.
bei einem pH-Wert von 1,2 ist das Thymolblau violettrot, bei einem pH-Wert zwischen 2,8-8 ist es gelb und bei einem pH-Wert von über 9,6 dann Blau.
Den Umschlag zu Blau kann ich verstehen, man hat 2 Auxochrome durch die Deprotonierten Hydroxygruppen und ein Antiauxochrom, das den Bathochromen Effekt der Auxochrome stark verstärkt, hinzu kommen die Alkylgruppen. Nur bei Gelb bin ich ein wenig verwirrt, weil das ja bedeutet, dass Licht mit einer geringeren Wellenlänge absorbiert wird, und dass obwohl doch eine Hydroxygruppe protoniert wurde und der Bathochrome Effekt so ja eigentlich verstärkt werden sollte.
1 Antwort
Hi,
wie du richtig festgestellte hast, hat Thymolblau zwei Umschlagpunkte. Die Grenzstrukturen sehen wie folgt aus:
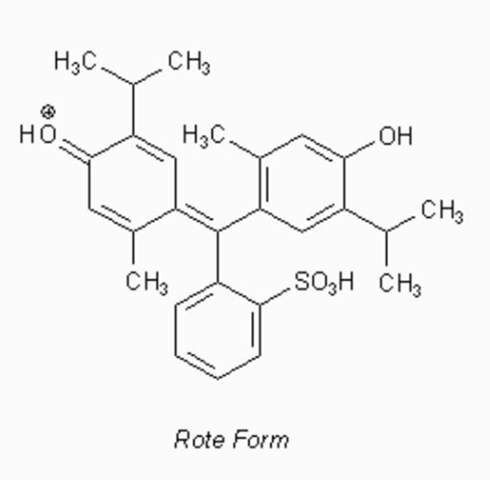
Thymolblau gehört wie Phenolphthalein zu den Triphenylmethan-Farbstoffen. Konkreter handelt es sich um ein Sulfonphthalein. Der im System enthaltene instabile Sultonring (also der Ring, an dem das eine Sauerstoffatome vom -SO3 gebunden ist) wird bereits im sauren Milieu gespalten, wodurch quasi ein chinoides System entsteht. Im stark sauren Bereich liegt diese Gruppe also protoniert vor. Du siehst, dass hier eine positive Ladung mesomeriestabilisiert werden muss. Das ist mit einer höheren Anregungsenergie verbunden als bei negativer Ladung. Die Farbe erscheint rot.
Bei der gelblichen Form ist der Sultonring geschlossen:
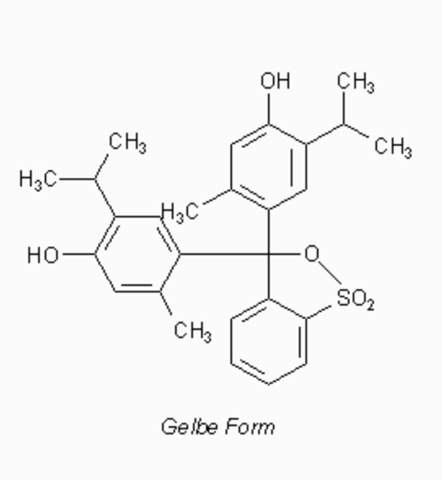
Das Chromophor wird also unterbrochen und die Mesomerie ist stark vermindert. Es gibt nun drei kleine Ringe, die jedes für sich ein Chromophor bilden. Daraus folgt ein bathochromer Effekt. Jetzt kommen auch die Substituenten ins Spiel: Normalerweise würde man, wie bei Phwnolphthalein, eine Farblosigkeit erwarten. Allerdings resultiert wegen dem starken +I-Effekt der Kohlenwasserstoffsubstituenten und den +M-Effekt des Sultonrings eine gelbe Färbung. Durch den Sultonring ist immerhin über zwei Ringe eine Mesomerie möglich. Dafür ist aber viel Energie erforderlich, also wir beobachten einen hypsochromen Effekt.
Die blau erscheinende Struktur sieht wie folgt aus:
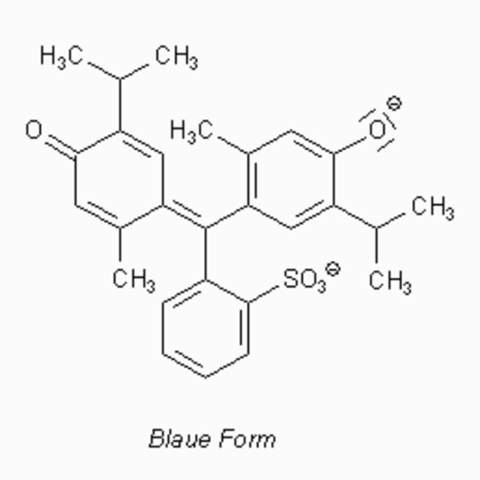
Hier ist der Sultonring gespalten und die Hydroxygruppen sind deprotoniert. Nun haben wir zwischen dem Sultonring und dem Sauerstoff links sowie zwischen dem Anion rechts und dem Sauerstoff links jeweils einen push-und-pull-Effekt. Die Mesomerie ist relativ stark, stärker noch als bei der rot erscheinenden Grenzstruktur, weshalb wir einen starken bathochromen Effekt beobachten.
LG



Vielen Lieben dank, für die ausführliche Erklärung!