Polarität von CO2?
Ich weiß, dass CO2 unpolar ist, aufgrund der Achsensymmetrie. Jedoch verstehe ich nicht ganz, warum das so ist. Warum sind dort keine Dipole trotz EN-Differenz? Warum würde CO2 nicht hydratisiert werden, obwohl die Sauerstoffe E-Dichte vom Kohlenstoff zieht?
3 Antworten
CO₂ ist keineswegs unpolar, es ist nur kein Dipol. Ein Dipol entsteht, wenn der Schwerpunkt der positiven Ladungen nicht mit dem Schwerpunkt der negativen Ladungen übereinstimmt. Das hat dann viel mit der Molekülsymmetrie zu tun.
CO₂ wid durchaus hydratisiert, zur Kohlensäure. Allerdings besagt die Erlenmeyer-Regel, dass 2 OH-Gruppen an einem C-Atom nicht stabil sind. Da spielen dann andere Faktoren eine Rolle, vielleicht die besondere Stärke einer C=O-Doppelbindung??
Das ist ja das spannende an der Chemie, all die vielen "Regeln", die einander widersprechen. Wusstest du, dass Formaldehyd in wässriger Lösung im Widerspruch zur Erlenmeyer-Regel zum großen Teil als "geminales Diol" Methandiol vorliegt? Ich wusste es jedenfalls bis vor kurzem nicht.
Kohlenstoffdioxid ist unpolar, da es eine lineare Struktur aufweist. Es könnte mit einer Waage verglichen werden, da an beiden Enden Sauerstoffatome sind. Somit gibt es keine ungleiche Verteilung der Valenzelektronen.
Bei Wasser sieht es anders aus: statt H=O=H lautet die Strukturformel
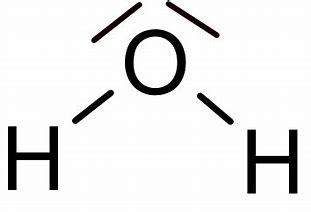

Nehmen wir einmal eine "Bildliche" Darstellung von CO2:
O=C=O
Nun, beide Sauerstoff-Atome ziehen von der genau entgegengesetzten Richtung an den Elektronen des Kohlenstoffs, was sich effektiv nulliert, wodurch keine Dipole entstehen. Stell dir vor zwei gleich starke Menschen ziehen an einem Seil - was passiert? Richtig, sie halten sich die Waage und das Seil bewegt sich nicht.
Du hast mich falsch verstanden, Wasser bildet keine Doppelbindungen aus, deshalb kann es sich ja auch frei drehen / mit den beiden freien Elektronenpaaren des Sauerstoffs interagieren. Sonst wäre die Darstellung der Bindungen beim Wasser eher sowas wie H-O-H :)
Deine bildliche Darstellung ist aber grottenschlecht/falsch.
"Bildliche" Darstellung von H²O - dann H=O=H, trotzdem Dipol.