Polare Bindungen und Dipole?
Ich hatte hier bereits eine Frage über WW mit Dipolen gefragt gehabt. Nun hab ich weitere Frage: Nur Bindungen können polar sein oder? Also keine Moleküle. Und Dipole bestehen aus polaren Bindungen, geht das auch ohne? Wenn ein Molekül einen Dipol hat, heißt es dann, das da ein Dipol ist oder nennt man das ganze Molekül ein Dipol, sprich Dipolmolekül?
1 Antwort
Ein Molekül bestimmt sich maßgeblich durch Bindungen zwischen Atomen! (Diese nennen sich intramolekulare Bindungen). Verbinden sich zwei polare Atome (erkennt man an der deltaEN), entsteht ein Dipol, wobei ein Atom elektronegativer (zieht die Elektronen mehr an) wird und das andere Atom dadurch elektropositiver.
Wie stark die Wirkung von polaren Verbindungen und die damit verbundenen Dipolkräfte ist, hängt von der Molekülgröße ab.
Ein Beispiel:Alkohole haben eine polare OH-Gruppe und ein unpolares Grundgerüst.
Je länger dieses unpolare Grundgerüst wird, desto weniger Einfluss nimmt die OH-Gruppe auf das Molekül. Ethanol ist wegen der Dipol-Dipol-WW (Erläuterung hierfür unten!) mit H2O sehr gut damit mischbar! 1-Decanol lässt sich hingegen kaum mit Wasser mischen, da die lange Kette dies räumlich verhindert. Dafür kommt es hier zu induzierten Dipolen, die dann zu Van-der-Waals-Kräften führen.
Diese zwischenmolekularen Bindungen (Dipol-Dipol,[H-Brückenbind.] und Van-der-Waals) nennen sich auch intermolekulare Bindungen.
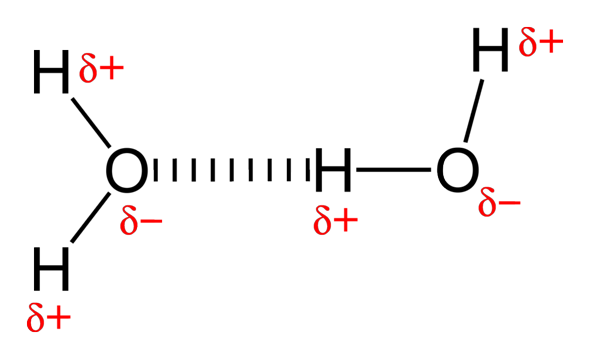
Dipol-Dipol-WW kommen zustande, wenn zwei polare Moleküle nebeneinander "liegen". Hierbei verbindet sich das partial negativ geladenere Atom des einen Moleküls mit dem partial positiver geladenem Atom des anderen Moleküls.
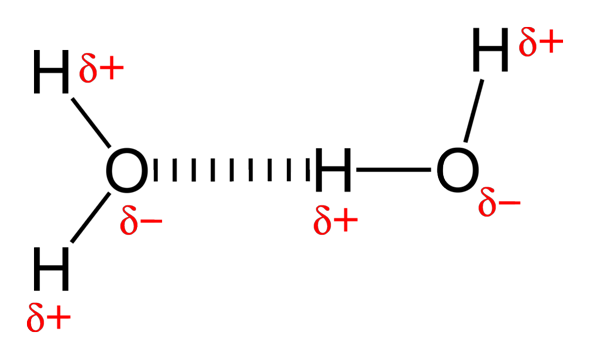
Wasser ist ein Beispiel hierfür. Wenn Wasserstoff daran beteiligt ist, kann man auch von Wasserstoffbrückenbindungen reden, die aber eigentlich auch nur Dipol-Dipol-WW sind. Aber sie kommen am häufigsten vor und gerade in der Biologie wird dieser Begriff bevorzugt verwendet, da er eindeutiger ist.
Zusatzwissen:
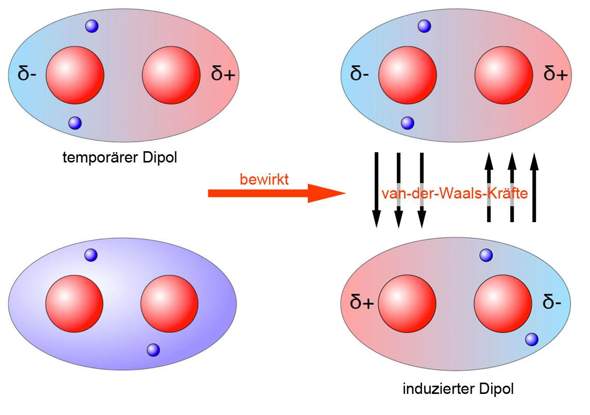
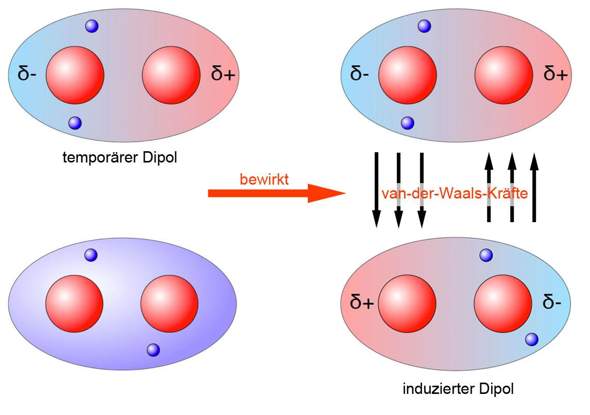
Du hast zwar nicht nach Van-der-Waals gefragt, aber das ist eigentlich auch wichtig: Hier entsteht zufällig ein kurzzeitig bestehender Dipol zwischen zwei unpolaren Atomen eines Moleküls.
Und wenn dies auch in einem anderen überwiegend unpolaren Molekül passiert ist, entsteht eine abgeschwächte Form der Dipol-Dipol-Bindung.