Massenkonzentration von Eisen(III)-Ionen?
Eisen(III)-hydroxid hat bei 25°C ein Löslichkeitsprodukt von 5*10^-38 mol^4/l^4. Berechnen Sie die Massenkonzentration der Eisen(III)-Ionen in einer gesättigten Lösung bei pH 10 in g/l.
Wenn ich mir die Konzentration über den pH-Wert ausrechne passt die Konzentration gar nicht mit der zusammen, die ich mir über die Löslichkeit errechne. Bzw. würde ich mit der Löslichkeit nie auf diesen pH kommen.
Oder verstehe ich die Fragestellung falsch ?
2 Antworten
KL= c(Fe³⁺) * c(OH⁻) * c(OH⁻) * c(OH⁻) = 5 *10⁻³⁸ mol⁴/L⁴
Bei pH 10 ist die H⁺-Ionenkonzentration c(H⁺) = 10⁻¹⁰ mol/L Und da immer gilt:
c(H⁺) * c(OH⁻) = 10⁻¹⁴ mol²/L²
ist die Hydroxidionen-Konzentration
c(OH⁻) = 10⁻⁴ mol/L
KL= c(Fe³⁺) * (10⁻⁴)³= 5 *10⁻³⁸ mol⁴/L⁴
c(Fe³⁺) = 5 *10⁻³⁸ mol⁴/L⁴/10⁻¹²mol³/L³
c(Fe³⁺) = 5 *10⁻²⁶ mol/L
Mit M(Fe) = 55,8 g/mol ergibt sich für die Massenkonzentration:
β(Fe) = 2,79 * 10⁻²⁴ g/L
Beim Vergleich mit der Avogadrozahl von 6,022 * 10²³ Atomen/mol hat man bei einer errechneten Konzentration von 5 * 10⁻²⁶ mol/L natürlich kein Fe³⁺-Ion mehr in der Suppe und somit auch keine reale Massenkonzentration.
Danke, ich habe es sogar auch so gerechnet, allerdings hat mich das Ergebnis so irritiert. Vielen Dank !!!
Wir haben ein Löslichkeitsprodukt Kₛₚ=5⋅10⁻³⁸ mol⁴/l⁴. Es beschreibt die Reaktion:
Fe³⁺ + 3 OH⁻ ⟶ Fe(OH)₃↓
Um die Fe³⁺-Löslichkeit bei pH=10 zu berechnen, ermitteln wir die zugehörige Hydroxid-Konzentration c(OH)=10⁻⁴ mol/l und berechnen c(Fe³⁺) aus dem Massenwirkungsgesetz:
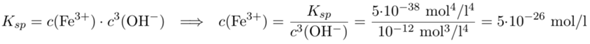
Da ist so unfaßbar wenig, daß in einem einem m³ Wasser gerade mal ein Fe³⁺-Ion herumschwimmen sollte. Zumindest sagt die einfache Rechnung das voraus.
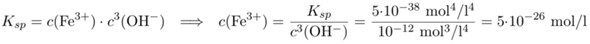
Allzu ernst kann man das Resultat nicht nehmen, weil es ja auch andere Formen von dreiwertigem Eisen außer hydratisierten Fe³⁺-Ionen gibt, von denen sich in der Lösung einige herumtreiben könnten. Eisen bildet z.B. mehrkernige Komplexionen aus einigen bis vielen Eisenatomen, die über O-Atome von H₂O oder OH⁻ verbunden sind, und die sind in dieser Rechnung natürlich nicht erfaßt.
Danke, ich habe es sogar auch so gerechnet, allerdings hat mich das Ergebnis so irritiert. Vielen Dank !!!