Kann mir mal einer bitte die Ph-Skala erklären?
Der PH- Wert ist ja der negative dekadische Logarithmus der H3O+ Ionenkonzentration. Aber warum ist bei der Konzentration der OH- Ionen dann alles genau umgekehrt? Ich weiß, das steht da schon in der untersten Formel, aber kann mir das vielleicht mal jemand mit Worten erklären?

1 Antwort
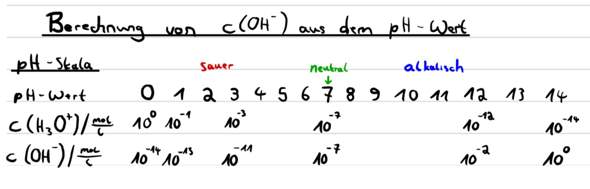
pH-Wert und pOH-Wert stehen chemisch in einem Zusammenhang, der nur rechnerisch wiedergegeben wird. Je höher die Oxoniumkonzentration, desto größer die Chance, dass ein Hydroxidion mit ihm zu Wasser reagiert. Umgekehrt natürlich genauso.
Deshalb sind in reinem Wasser je 10⁻⁷ mol/l Oxonium und Hydroxid, aber wenn du die Oxomiumkonzentration vertausendfachst, auf 10⁻⁴ mol/l, dann verringert sich die Hydroxidkonzentration auf ein tausendstel, 10⁻¹⁰ mol/l.
Das Produkt der Oxonium- und der Hydroxidionen ist konstant, 10⁻⁷*10⁻⁷, 10⁻⁴*10⁻¹⁰ oder ein anderes Produkt, aber stets 10⁻¹⁴. Genauer natürlich mit Einheiten, also z.B. 10⁻⁴mol/l*10⁻¹⁰mol/l=10⁻¹⁴mol²/l².
Logarithmiert ergibt sich daraus pH+pOH=14.
Solche Produkte findest du übrigens auch anderswo, bei der Löslichkeit z.B., als Löslichkeitsprodukt. Auch hier ist der Hintergrund erst mal chemisch, Mathe ist nur Mittel zur Beschreibung.