Chemie - Experiment?
Guten Tag.
Ich würde gerne um Ihre Hilfe bitten - könnte mir bitte jemand das angefügte Experiment erklären? Ich verstehe zwar den Grundaufbau - jedoch komme ich nicht "weiter".
Weshalb wird das Gleichgewicht beispielsweise "gestört"?
Vielen Dank - ihr müsst bitte auf "volle Größe" drücken, da die Bilddatei leider zu groß ist.
Ergänzung - Bild

Leider sieht man nichts ;(

Ich habe es jetzt noch einmal probiert - normalerweise sollte nun ein Bild vorhanden sein.

Und wo soll ich drücken? Da ist bei mir nix.

Ich habe es jetzt noch einmal probiert - normalerweise sollte nun ein Bild vorhanden sein.

Bitte Frage bearbeiten/ergänzen und Bild anfügen

Ich habe es jetzt noch einmal probiert - normalerweise sollte nun ein Bild vorhanden sein.
3 Antworten

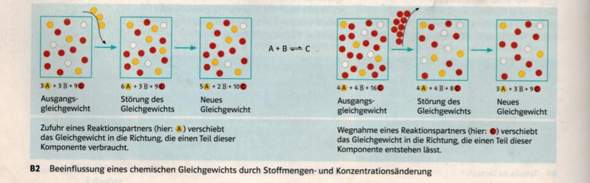
a) Bilderdreiergruppe links:
Bild 1: Die Stoffe A, B und C sind in bestimmten Konzentrationen vorhanden. Äußerlich ist keine Reaktion im Gefäß zu sehen: es herrscht chemisches Gleichgewicht.
Bild 2: In das Gefäß wird zusätzlich Stoff A gegeben. Die Konzentration von Stoff C dividiert durch das Produkt der Konzentrationen von A und B stimmt nicht mehr mit der Massenwirkungskonstane K für diese Reaktion überein: Das Gleichgewicht ist gestört.
Bild 3: Angenommen, C wäre eine farbige Substanz und A sowie B seien farblos, dann würde man jetzt eine Zunahme der Farbe im Reaktionskolben feststellen. Wenn sich die Farbe nicht mehr ändert, dann hat sich das neue Gleichgewicht eingestellt.
b) Versuche nun für die Bilderdreiergruppe rechts die drei Bilder zu interpretieren.

Moin,
es geht um die Beeinflussung einer chemischen Gleichgewichtsreaktion und die Folgen dieser Einflussnahme.
Eine Reaktion befindet sich in einem dynamischen Gleichgewicht. Stoff A und Stoff B reagieren in einer sogenannten Hinreaktion zu Stoff C:
A + B ---> C
Gleichzeitig zerfällt der Stoff C in einer sogenannten Rückreaktion auch wieder in die Ausgangsstoffe A und B:
C ---> A + B
Irgendwann stellt sich zwischen der Hin- und der Rückreaktion ein dynamisches Gleichgewicht ein. Dynamisch bedeutet dabei, dass stets Hinreaktionen erfolgen, aber eben auch Rückreaktionen. Gleichgewicht bedeutet in diesem Zusammenhang, dass sich in der Bilanz kein Unterschied in den Konzentrationen feststellen lässt. Das heißt, im Gleichgewicht erfolgt irgendwo im Reaktionsraum die Hinreaktion und gleichzeitig an einem anderen Ort des Reaktionsraums die Rückreaktion. Darum verändert sich an den Stoffmengen der beteiligten Reaktanten A, B und C im Gleichgewichtszustand nichts mehr, obwohl ständig Hin- und Rückreaktionen erfolgen (dynamisches Gleichgewicht eben!)
Gleichgewicht bedeutet nicht, dass von den Stoffen A, B und C gleich viel vorhanden sein muss. Deshalb kann es sein, dass im Gleichgewicht zum Beispiel von Stoff C mehr vorhanden ist, als von den Stoffen A und B. Das ist zum Beispiel in deiner Abbildung in der ersten Darstellung der Fall. Von den Stoffen A oder B gibt es (zufälligerweise) gleich viel, nämlich jeweils 3... Von Stoff C ist dagegen im Gleichgewicht 9... vorhanden. In einem solchen Fall sagt man, das Gleichgewicht liege auf der Seite von Stoff C.
Soweit zum Begriff „dynamisches chemisches Gleichgewicht”.
Nun kann man solche Gleichgewichte stören. Dazu stehen einem zwei bis drei Methoden zur Verfügung, nämlich
- die Veränderung der Konzentration
- die Veränderung der Temperatur
- und / oder bei Reaktionen in der Gasphase die Veränderung des Drucks
In deinem Beispiel geht es konkret um die Veränderung der Konzentration (der Stoffmengen). Du kannst die Stoffmenge eines (oder mehrerer) Teilnehmers erhöhen (erster Fall in deiner Abbildung) oder verringern (zweiter Fall).
Wie reagiert nun dein System, das vorher im Gleichgewicht war, auf eine solche Störung?
Wenn du die Menge des Stoffes A erhöhst (siehe linke Abbildung), dann erhöhst du damit die Wahrscheinlichkeit, dass ein Teilchen B auf ein Teilchen A trifft. Logisch, oder? Aber mit der Erhöhung der Wahrscheinlichkeit, dass sich A und B treffen und miteinander reagieren können, erhöht sich auch die Bildung von Stoff C.
Das drückt man sprachlich so aus, dass man sagt: Es stellt sich ein neues Gleichgewicht ein, in dem nun mehr Stoff C gebildet wird. Das Gleichgewicht reagiert also auf die Erhöhung der Stoffmenge A so, dass es diesen Stoff nun mehr verbraucht (und dadurch Stoff C entsteht). Das neue Gleichgewicht verschiebt sich in diesem Fall noch mehr auf die Seite von Stoff C.
Wenn du umgekehrt die Stoffmenge der Komponente B verringerst (in diesem Fall halbierst), wird damit auch die Wahrscheinlichkeit kleiner, dass ein Teilchen von Stoff A auf ein Teilchen von Stoff B trifft und mit diesem reagieren kann. Das begünstigt die Rückreaktion, also den Zerfall von Stoff C. Es stellt sich auch hier ein neues Gleichgewicht ein, in dem mehr von Stoff C zerfällt (und dadurch Stoff B „nachgeliefert” wird).
Allgemein bezeichnet man dieses Phänomen als Prinzip von Le Chatelier (oder als das Prinzip des kleinsten Zwangs).
Ein System, das sich in einem chemischen dynamischen Gleichgewicht befindet, weicht einem von außen kommenden Zwang (einer Störung durch Konzentrations-, Temperatur- oder / und Druckveränderung) so aus, dass der Zwang möglichst klein wird.
Alles klar?
Zum Spaß könntest du dir ja einmal überlegen, inwieweit eine Temperatur- oder Druckveränderung Einflüsse auf Gleichgewichtsreaktionen darstellen (können) und wie entsprechende Systeme reagieren werden.
Als Beispiel könntest du die Reaktion
3 H2 (g) + N2 (g) ---><--- 2 NH3
nehmen, die in der Hinreaktion leicht exotherm (energiefreisetzend) ist...
LG von der Waterkant

Dir mal einen Hinweis:
Eine Störung kann durch Konzentration, Druck- oder Temperaturänderung eintreten. Dieser Störung wird versucht immer auszuweichen. Das kann auch durch Bildung neuer Produkte passieren.