Bruttostabilitäskonstante von einem Komplex berechnen?
Hallo, ich möchte die Bruttostabilitätskonstante von [Cu(NH3)4]2+
bestimmen. Ich habe 50 mL Cu und 0,75 mL NH3 verwendet um den Komplex zu erzeugen.. wie errechne ich jetzt diese Konstante ? Es wäre sehr schön, wenn mir jemand helfen kann !!!!
Massenwirkungsgesetz wäre das hier:
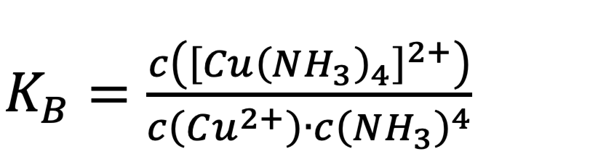
Ich muss irgendwie mit der Nernstschen Gleichung arbeiten.. aber ich komme einfach nicht auf ein gutes Ergebnis.
(E°(Cu2+/Cu) = 0,35 V, E°(Zn2+/Zn) = -0,76, c(Zn2+) = 0,1 mol/L)
Danke für die Hilfe !!!
Cu (w = 0,1) und NH3 (w = 0,25)
EMK nach Erzeugung des Komplexes = 0,9 V
1 Antwort
Mit Nernst hat die Frage absolut nichts zu tun. Was sollen da die Normalpotentiale von Cu und Zn? Zn ist in der Aufgabenstellung nirgendwo erwähnt. Die Ergänzung der Massenanteile von Cu und NH3 ist schon einmal ein Schritt in die richtige Richtung. Nun müsste noch präzisiert werden, ob es sich um die Anteile in den Ausgangslösungen handelt, also um w0(Cu) und w0(NH3), oder aber um die Massenanteile nach der Gleichgewichtseinstellung. Wie dem auch sei, es fehlt auf jeden Fall noch eine weitere Gehaltsangabe, um die Komplexbildungskonstante berechnen zu können.
Vielleicht solltest Du die gesamte Aufgabe einstellen.
Mit den Angaben habe ich die Cu²⁺-Konzentration im Gleichgewicht nun zu 8,55 * 10⁻⁹ mol/L berechnet. Nun müssten die Ausgangsgehalte von Massenanteilen auch in die Stoffmengenkonzentrationen umgerechnet werden. Dazu bedarf es der Lösungsdichten. Auch scheinen mir die Angaben Cu = 0,1 und NH3 = 0,25 recht unrealistisch. w = 0,1 sind 10 %mas und 0,25 sind 25 %mas. Ich glaube kaum, dass man eine Lösung, die 10 %ig an Kupferionen ist, überhaupt herstellen kann.
Danke schonmal.. ich habe c(Cu²⁺) = *10^-9 mol/L ermittelt .. ist ja schon recht nahe.. Weiter komme ich nicht ... Ja also genauer gesagt wird mit Kupfersulfat-Lösung CuSO4*5H2O(aq), c = 0,1 mol/L in Na2SO4(aq) mit w = 0,1 gearbeitet ...
das für Ammoniak stimmt aber soweit .. wie komme ich nun weiter ? Danke!!
Also ist die anfängliche Stoffmengenkonzentration für Cu0²⁺ = 0,1 mol/L. Davon 50 mL sind n(Cu²⁺) = 0,005 mol. Auf Gesamtvolumen V = 50,75 mL ergibt sich c(Cu²⁺) = 0,0985 mol/L
w(NH3) = 0,25 entspricht einer Stoffmengenkonzentration von c = 13,31 mol/L. Davon sind 0,75 mL n = 0,010 mol Endkonzentration in 50,75 mL ist c(NH3) = 0,197 mol/L
Die Ammoniakkonzentration ist also nur doppelt so groß wie die der Kupferionen. Da über die die elektrochemischen Rechnung die freie Cu-Konzentration bei etwa 10⁻⁹ mol/L bestimmt wurde, würde das bedeuten,dass praktisch die gesamte anfängliche Kupfermenge in Form des Komplexes vorliegt. Das kann aber nicht sein, weil dazu die Ammoniakmenge bei weitem nicht ausreichend ist. Daher komme ich bei meinen Rechnungen nicht weiter.
Danke aufjedenfall schonmal für die Mühe !
Ich habe den Komplex erzeugt und dann die EMK von 0,9 V gemessen .. über die Nernst-Gleichung soll dann die Konzentration c(Cu2+) errechnet werden ..
Es handelt sich um die Anteile der Ausgangslösung.