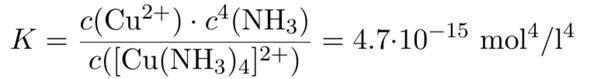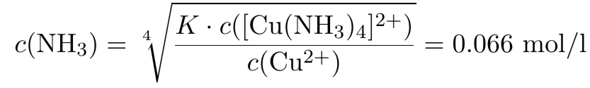Konzentration der freien Cu 2+ Ionen reduzieren?
Wie viel µL einer wässrigen NH3-Lösung mit einer Stoffmengenkonzentration von 3,8 mol/L muss man zu 194 mL einer Cu(NO3)2-Lösung (c = 0,004 mol/L) geben, um die Konzentration der freien Cu2+-Ionen auf 10-12 mol/L zu reduzieren?
Komplexzerfallskonstante KD: 4,7·10-15
Ansatz:
Reaktionsglg -> Cu(NO3)2 + 4 NH3 -> [ Cu(NH3)4](NO3)2
1 Antwort
Die Cu²⁺-Lösung ist sehr verdünnt (c₀=0.004 mol/l), die NH₃-Lösung sehr konzentriert (c₁=3.8 mol/l). Versuchsweise nehme ich an, daß das zugegebene Volumen sehr klein sein wird und nichts Wesentlichen am Gesamtvolumen V₀=194 ml ändern wird.
Die angegebene Gleichgewichtskonstante ist die Komplexdissoziationskonstante und nicht die -bildungskonstante, also schreiben wir die Reaktion als Zerfall des Komplexes auf:
[Cu(NH₃)₄]²⁺ ⟶ Cu²⁺ + 4 NH₃
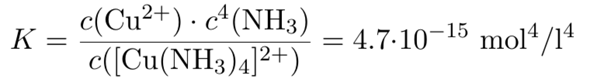
Wir wollen c(Cu²⁺) auf 10¯¹² mol/l drücken; in diesem Fall wird praktisch alles Kupfer komplexiert, also wird die Konzentration des Kupfertetraminkomplexes gleich der gegebenen Kupferkonzentration c₀=0.004 mol/l sein. Wir kennen also alles in dieser Formel und können nach c(NH₃) auflösen:
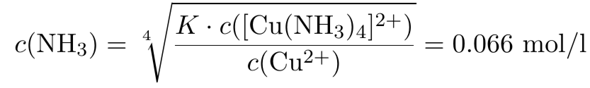
Das ist die Gleichgewichtskonzentration des freien Ammoniaks. Außerdem ist noch 4c₀ Ammoniak als Kupferkomplex gebunden, das macht dann insgesamt 0.082 mol/l Ammoniak, die zugegeben werden müssen, das entspricht einer Stoffmenge n=cV₀=15.9 mmol in den gesamten V₀=194 ml Suppe.
Um diesen Ammoniak zuzusetzen, haben wir eine c₁=3.8 mol/l Ammoniak-Lösung zur Verfügung, und davon brauchen wir V=n/c=4.179 ml bzw. 4179 µl bis wir die nötige Stoffmenge haben.
Wie Du Dich erinnerst, haben wir anfangs angenommen, daß sich an den V₀=194 ml durch das Zusetzen des NH₃-Lösung nicht viel verändern wird; wir setzen aber gut 4 ml zu, das sind gut 2% Volumsänderung zu einem neuen Gesamtvolumen V₁=198.2 ml. War die Näherung trotzdem gerechtfertigt?
Dazu rechnen wir aus dem Endergebnis die Komplexbildungskonstante neu aus und hoffen, daß wir den richtigen Wert erhalten. c(Cu²⁺) ist natürlich immer noch 10¯¹² mol/l, c(Komplex)=c₀⋅V₀/V₁ wegen der Verdünnung und c(NH₃) ist die zugesetzte Stoffmenge NH₃ c₁V minus dem komplexierten Teil 4c₀V₀ und das ganze im neuen Volumen V₁, also (c₁V−4c₀V₀)/V₁.
K = 10¯¹² ⋅ ((c₁V−4c₀V₀)/V₁)⁴ / (c₀⋅V₀/V₁) = 4.4⋅10¯¹⁵ mol⁴/l⁴
Der gegebene Zahlenwert war 4.7⋅10¯¹⁴ mol⁴/l⁴. Das scheint mir gerade noch tolerabel (≈7%). Eine genauere Rechnung gibt V=4.233 ml, also ungefähr 0.05 ml oder einen Tropfen mehr, als wir oben ausgerechnet haben.
P.S.: Rechenfehler gefunden und korrigiert — Klammern sind für Nerds!