Berechnen Sie den pH-Wert einer Natronlauge mit der Konzentration 1 * 10 hoch minus 8?
Einen Ansatz?
3 Antworten

1. fehlt da die Einheit
2. man berechnet den pOH und rechnet dann in pH um!


Hier mal die Antwort die erwartet wird. Im Heft haben wir eine Lösung zu einer Aufgabe, dessen Problem ähnlich ist. Die Lösung ist hierbei nicht die Berechnung des exakten pH-Werts, sondern nur eine Näherung.
Natronlauge ist eine starke Base und dissoziiert daher vollständig. Die Konzentration der Natronlauge beträgt 1 * 10-8 mol/l. Die Konzentration der Hydroxidionen ist demnach genauso groß: [OH-] = 1 * 10-8 mol/l.
Nun ist allerdings das Problem, das eine Konzentration von 1 * 10-8 mol/l = 0,00000001 mol/l entspricht. Es handelt sich also um eine stark verdünnte Base und somit muss die Autoprotolyse von Wasser berücksichtigt werden. Daher können wir den pH-Wert nur mit der Näherungsweise berechnen! Dafür verrechnen wir zuerst die Hydroxidionen, die durch die Autoprotolyse des Wasser vorliegen, mit den Hydroxidionen der Natronlauge:
[OH-]NaOH + [OH-]Wasser = 1 * 10-8 + 1 * 10-7 = 1,1 * 10-7
Nun können wir die gewohnte Formel anwenden:
pOH = -log [OH-] = -log (1,1 * 10-7) = 6,96
pH = 14 – pOH = 14 – 6,96 = 7,04
Somit beträgt der pH-Wert einer Natronlauge mit einer Konzentration von 1 * 10-8 mol/l ≈ 7,04.

c=10⁻⁸ mol/l ⟹ pH=7.02
Das kannst Du Dir mit dem Massenwirkungsgesetz unter Berücksichtigung der Autoprotolyse selbst ausrechnen. Der Ansatz ist, daß die Autoprotolyse ein paar OH⁻-Ionen liefert, die zu denen der NaOH dazukommen. Die Endformel ist dann (gilt für starke Basen ganz allgemein):
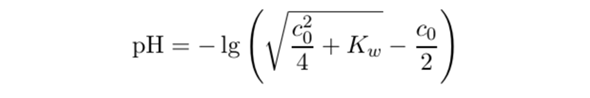
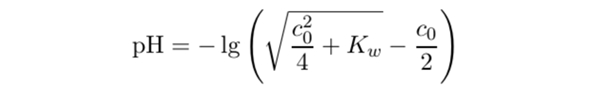


Kw ist die Wasserkonstante 10⁻¹⁴ mol²/l², und cō ist die Konzentration 10⁻⁸ mol/l.
Mit dieser Formel kannst Du den pH-Wert einer starken Säure bei jeder Konzentration ausrechnen. Für c₀>10⁻⁶ mol/l kommt dabei im wesentlichen −lg(c₀) raus, für c₀<10⁻⁸ mol/l kommt 7 heraus.
Die Formel geht auch für Basen, dann mußt Du einfach 14−Resultat nehmen.

Hab mehrmals nachgerechnet, da ist -14 rausgekommen... Die Formel ist sogar richtig, ich hab sie im Internet gerade mehrmals gefunden, dann liegt es irgendwie an mir... Trotzdem danke :)

Zunächst einmal: Ich habe Blödsinn gschrieben, die Formel gilt direkt für c₀ als Basenkonzentration, man braucht kein 14−Resultat. Aber sonst stimmt sie, glaube ich:
pH = −lg(√(c₀²/4+Kw)−c₀/2) =−lg ( √(10⁻¹⁶/4 +10⁻¹⁴) − 10⁻⁸/2 ) =
−lg ( √( 1.0025⋅10⁻¹⁴ ) − 5⋅10⁻⁹ = −lg ( 1.00125⋅10⁻⁷ − 5⋅10⁻⁹ ) =
−lg ( 9.51⋅10⁻⁸ ) = 7.02
Entschuldige, dass ich nachfrage, muss ich bei -lg dann -8 einsetzen? Und was bedeuten CO und KW?
Ich hab einen ziemlich schlechten Chemie-lehrer und bin wirklich sehr verzweifelt, deswegen wäre ich für jede Hilfe extrem dankbar 😅🌺