Anhand des pKs und pKb Wertes bestimmen ob, Hydrogensulfationen (H2SO4) in wässriger Lösung sauer oder alkalisch reagieren?
Die Aufgabe ist : Entscheiden Sie anhand des pKs und des pKb Wertes (siehe Tabelle) begründet, ob Hydrogensulfationen in wässriger Lösung sauer oder alkalisch reagieren.
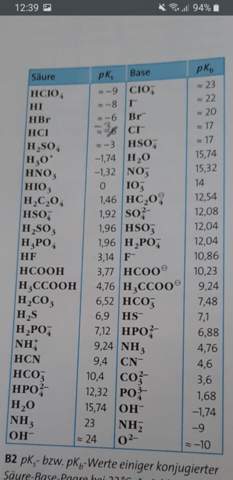
Wäre toll wenn mir jemand helfen würde :)
Danke im voraus 🙃
2 Antworten
HSO₄⁻ ist ein Ampholyt, der mit H₂O in zwei Richtungen reagieren kann:
HSO₄⁻ + H₂O ⟶ SO₄²⁻ + H₃O⁺ (HSO₄⁻ reagiert als Säure)
HSO₄⁻ + H₂O ⟶ H₂SO₄ + OH⁻ (HSO₄⁻ reagiert als Base)
In Deiner Tabelle siehst Du, daß die Säurekonstante pKₐ für HSO₄⁻ 1.92 beträgt, das entspricht einer mittelstarken Säure. Bei der Basenkonstante siehst Du aber ≈17, das ist superschwach, tatsächlich so schwach, daß man zumindest in verdünnten wäßrigen Lösungen niemals eine Reaktion als Base erwartet (weil H₂O eine viel stärkere Base ist in daher bevorzugt die H⁺ selber schluckt). Das ist natürlich äquivalent zur Feststellung, daß H₂SO₄ eine sehr starke Säure ist, also in verdünnter wäßriger Lösung niemals als Molekül vorliegt, sondern immer zumindest ein H⁺ ans Wasser abgibt.
MERKE: Der kleinere Wert gewinnt!
pKs = 1,92
pKb = 17
=> pKs ist kleiner und "gewinnt". D.h. HSO4(-) reagiert als Säure.
Hilft dir das weiter?
VG