Zink- Iod- Batterie?
Kann mir einer das ausführlich unnd einfach erklären?
Danke euch jetzt schon für die antworten
2 Antworten

Moin,
das ist der Entladevorgang eines Zink-Iod-Akkus. Das geht so:
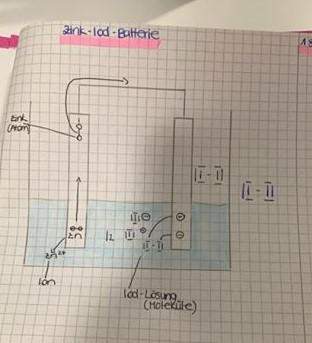
Du hast zwei Elektroden, die in eine Lösung eintauchen. Eine besteht aus Zink (in deinem Bild links), die andere zum Beispiel aus Kohlenstoff oder Kupfer... In der Lösung befindet sich elementares Iod (I2-Moleküle). Sehr geeignet ist dafür zum Beispiel eine Iod-Kaliumiodid-Lösung (Lugolsche Lösung).
Wenn du nun also deine beiden Elektroden in die Lösung hältst, dann lösen sich von der Zink-Elektrode Zinkionen (Zn^2+) ab und gehen in die Lösung. Dadurch wird die Menge der positiven Ladungsträger in der Lösung erhöht. In der Elektrode lassen die ehemaligen Zinkatome jeweils zwei Elektronen zurück.
Da die Elektroden miteinander über einen stromleitenden Draht (zum Beispiel ein Kabel) in Verbindung stehen, wandern die zurückgelassenen Elektronen nun über diese Verbindung zur anderen Elektrode.
Da diese Elektrode ebenfalls in die Lösung eintaucht, kann sie die Elektronen an die Iodmoleküle in der Lösung abgeben. Die Iod-Minimoleküle (I2) werden dadurch in zwei Iodid-Anionen (2 I^–) gespalten und erhöhen so den Anteil an negativen Ladungsträgern in der Lösung.
Die Vorgänge an den Elektroden sind demnach:
Zinkelektrode (Anode): Zn ---> Zn^2+ + 2 e^– (Oxidation)
andere Elektrode (Kathode): I2 + 2 e^– ---> 2 I^– (Reduktion)
Da bei diesem Gesamtvorgang also einerseits Elektronen, andererseits in der Lösung Ladungsträger in Form von Ionen bewegt werden, erhältst du einen geschlossenen Stromkreislauf. Immerhin bedeutet Stromfluss ja nichts anderes als bewegte Ladungsträger (Elektronen und / oder Ionen).
Wenn du zwischen die Elektroden einen Verbraucher schalten würdest (zum Beispiel einen Minipropeller oder ein Lämpchen mit einem geringen elektrischen Widerstand, dann könntest du diese Verbraucher mit dem Stromfluss zum Laufen bzw. Leuchten bringen.
Wenn du dagegen ein Spannungsmessgerät zwischen die Elektroden schalten würdest, könntest du sehen, dass eine Spannung anliegt (die aber zunehmend schwächer würde). Ein Stromflussmessgerät würde dir einen Stromfluss anzeigen.
Wenn du diesen Versuchsaufbau zu lange stehen lässt, wird sich die Zink-Elektrode zunehmend auflösen.
Nur der Vollständigkeit halber: Wenn du schließlich einen Gleichstromgenerator zwischen die Elektroden anschließen würdest, könntest du den Vorgang umkehren. Dann würden an die Zinkelektrode Elektronen geliefert werden, so dass sich Zinkionen aus der Lösung an der Elektrode absetzen würden, weil sie dort mit zwei Elektronen versorgt und wieder zu elementaren Zinkatomen würden.
An der anderen Elektrode würden dagegen Iodid-Anionen jeweils ein Elektron abliefern und zu elementaren Iod-Minimolekülen werden. Das wäre dann der Aufladevorgang deines Zink-Iod-Akkus, aber der ist in deiner Abbildung nicht zu sehen...
Alles klar?
LG von der Waterkant

Hmm, ist nicht ganz so einfach. ich versuch´s etwas ausführlicher:
Das ist genau das Gleiche wie jede andere Batterie /Galvanische Zelle, nur daß in deinem speziellen Fall das Potential (die Spannung) zwischen den beiden Elektroden aus Zink und Iod entsteht. (siehe elektrochemische Spannungsreihe, wie üblich)
m.f.G.
anwesende