Wieso ist Siliciumdioxid fest, Kohlendioxid aber nicht?
Wie kann das sein, dass Siliciumdioxid in der Formel Kohlendioxid entspricht, aber im Gegensatz zum Kohlendioxid ein Feststoff (Mineral Quarz) ist?
(keine Hausaufgaben. Es hat mich nur im Unterricht irritiert.)
danke :)
1 Antwort
Der Kohlenstoff kann sehr gut Mehrfachbindungen ausbilden und tut dies beim Kohlendioxid auch (s.u.).
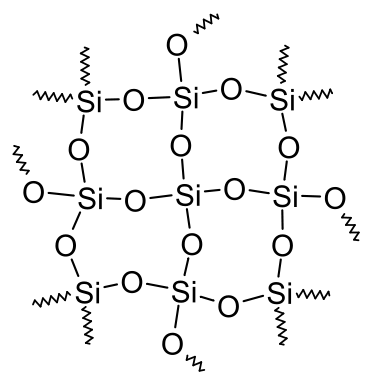
Silicium hingegen kann das (bis auf wenige Ausnahmen) nicht. Daher bildet SiO2 eine Netzwerkstruktur aus, welches der Verbindung bei Raumtemperatur nicht erlaubt flüssig oder gasförmig zu sein. Das hängt damit zusammen, dass Silicium in der 3. Periode ist, und d-Orbitale besitzt.
Wikipedia sagt dazu
In allen in der Natur auftretenden und in der überwiegenden Zahl der synthetisch hergestellten Verbindungen bildet Silicium ausschließlich Einfachbindungen aus. Die Stabilität der Si-O-Einfachbindung im Gegensatz zur C-O-Doppelbindung ist auf ihren partiellen Doppelbindungscharakter zurückzuführen, der durch Überlappung der freien Elektronenpaare des Sauerstoffs mit den leeren d-Orbitalen des Siliciums zustande kommt.

Warum soll ich noch meinen Senf dazu geben, wenn die Frage intelligent und kompetent beantwortet wurde!