Wieso bleibt der pH-Wert einer Pufferlösung beim Verdünnen konstant?
müsste er nicht zunehmen...?
2 Antworten
Beim Verdünnen einer wäßrigen Lösung mit reinem Wasser wird sich der pH immer auf 7 zubewegen — denn im Limit unendlicher Verdünnung ist alles reines Wasser und reagiert daher neutral. Ob der pH eines Puffers beim Verdünnen steigt oder sinkt, hängt also nur davon ab, ob der Puffer am Anfang sauer oder basisch war.
Allerdings vertragen Pufferlösungen typischerweise ziemlich viel Verdünnung, bis sie ihren pH merklich ändern. Die handelsüblichen Acetat- oder Phosphatpuffer werden meist im Konzentrationsbereich 1 mol/l bis 0.1 mol/l verwendet; man kann sie aber auf etwa 0.0001 mol/l verdünnen, ohne daß sie beim pH merklich abweichen (natürlich haben sie in solcher Verdünnung nur noch sehr geringe Pufferkapazität).
Ich zeige Dir das an einem Bild, das die Verdünnung eines symmetrischen Essigsäure/Acetat-Puffers veranschaulicht. Der Ausgangspuffer enthält je 1 mol/l an Essigsäure und Natriumacetat.
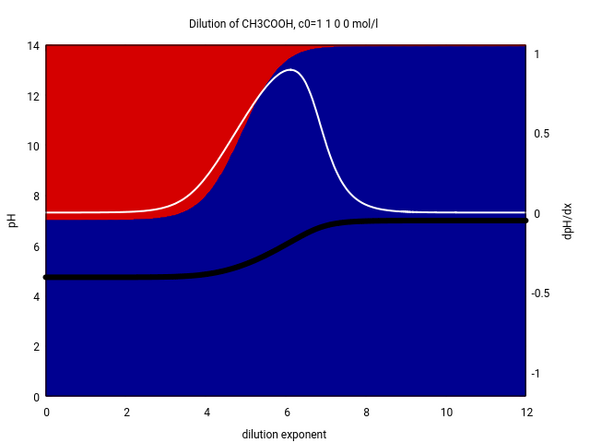
Die x-Achse gibt die Verdünnung an, also entspricht der Wert 2 einer Verdünnung aufs 10²=100fache Volumen. Die schwarze Kurve ist der pH, die weiße die Steigung (pH-Änderung bei Verdünnung aufs Zehnfache), und die Hintergrundfarben zeigen das Protolysegleichgewicht (Essigsäure rot, Acetat blau).
Du siehst, daß sich bei Verdünnung bis auf 10⁴ praktisch nichts tut: Der pH bleibt am Ausgangswert (dem pKₐ der Essigsäure, 4.75) fest, und in der Lösung tummeln sich Essigsäure und Acetat in gleichen Mengen. Danach steigt der pH, es befindet sich mehr Acetat in der Lösung als Essigsäure, und jenseis einer Verdünnung auf 10⁷ ist das das Ende erreicht: Der pH beträgt 7, es gibt kaum noch freie Essigsäure in der Lösung, und eigentlich handelt es sich eh nur noch um fast reines Wasser.

Die Dissoziation ist aber konzentrations- und pH-abhängig. Wie es genau ist siehst Du am Massenwirkungsgesetz:
Kₐ = c(H₃O⁺) ⋅ c(A⁻) / c(HA) oder c(A⁻)/c(HA) = Kₐ/c(H₃O⁺)
Im Limit der Verdünnung muß c(H₃O⁺)=10⁻⁷ mol/l sein, und das bestimmt das Verhältnis zwischen Acetat und Essigsäure: Kₐ≈10⁻⁵ mol/l, also muß in neutraler Lösung das Acetat/Säure-Verhältnis ungefähr 100:1 sein.
P.S.: Dem Dissoziationsgleichgewicht ist es ja egal ob der pH=7 durch Verdünnung oder anders zusammenkommt. Wenn Du in einen Phosphat-Puffer von pH=7 einen Tropfen Essigsäure gibst, dann wird sie ja auch zum Acetat deprotoniert.
Vielen Dank. Jetzt ist mir das klar geworden.
Bei Zusatz geringer Mengen OH-- oder H3O+-Ionen zur Lösung kommt es zur Neueinstellung des Protolysegleichgewichtes der das Puffersystem bildenden Säure und Base und somit zu einer Veränderung des Konzentrationsverhältnisses. Weil dieses Verhältnis jedoch im logarithmischen Glied der o. a. Gleichung steht, wirkt sich diese Veränderung nur sehr unbedeutend auf den pH-Wert aus, d. h., der pH-Wert der Lösung bleibt praktisch konstant.
Vielen Dank für die ausführliche Antwort. Ich verstehe jedoch nicht, wieso die Konzentration der Essigsäure bei fortlaufender Verdünnung abnimmt. Essigsäure ist ja eine schwache Säure und dissoziiert zu weniger als 1% d.h. ihre Konzentration müsste doch gleich bleiben.