Wie viele Elektronen gibt ein Atom in einer Nebengruppe ab?
Hallo,
Ich wollte fragen ob ich irgendwie wissen kann wie viele elektronen ein Atom in den nebengruppen abgibt oder man die irgendwie auswendig lernen muss? Bei den Hauptgruppen gibt man ja je nach Hauptgruppe ab oder nimmt auf, aber wie ist das eig in der 4. Hauptgruppe?
Danke Im voraus
LG
3 Antworten
Die Atome der Nebengruppen geben anfangs erst mal maximal so viele so viele Elektronen, wie es der Gruppennummer entspricht, also z.B. Titan 4, Molybdän 6, usw. Das aber nur bis zu einem Maximum, das in der ersten Reihe beim 7 oder Mangan liegt, in der 2. Reihe beim 8 oder Ruthenium, in der 3. Reihe bei 9 oder Iridium. Danach sinkt die Anzahl wieder bis zum Zink, Cadmium und Quecksilber mit max. 2.
Allerdings sind die hohen Oxidationszahlen in der rechten Hälfte auch seltener, da überwiegen +2 und +3, in der Kupfergruppe auch +1. Die Metalle der 2. und 3. Reihe mögen hohe OZ lieber.
Übrigens ist das auch bei den Hauptgruppen keineswegs so einfach, wie man es im Anfängerunterricht lernt. Da könnte ich ohne Nachdenken etliche Seiten zu schreiben.
Nochmal zu den Nebengruppen, da gibt es natürlich Regeln, aber etliche, die sich teils ergänzen, teils widersprechen. Unverständlich für Anfänger sind sie noch dazu. Mein Tipp: Merk dir alles, was im Unterricht drankommt oder du sonstwo aufschnappst.
Ich recycle eine alte Antwort von mir, und verweise noch auf eine andere und noch eine andere.
Da kann man keine Faustregeln angeben. Das folgende stimmt aber größtenteils:
- In der Scandiumgruppe ist nur +III möglich.
- Die Zinkgruppe ist ziemlich strikt zweiwertig, außer Quecksilber, das bildet auch ein Hg₂²⁺ mit Oxidationszahl +I.
- Bei der Kupfergruppe ist es chaotisch; es ist sogar bei allen +I möglich, was sonst kaum vorkommt. Bevorzugt sind Ag⁺, Cu²⁺ und Au³⁺.
- Die anderen Übergangsmetalle können immer +II und +III bilden. Die leichten Übergangsmetalle (außer Ti und V) bevorzugen stets eine dieser beiden: Cr³⁺, Mn²⁺, Fe³⁺, Co²⁺ und Ni²⁺.
- Die maximale Oxidationsstufe steigt von der Lanthan- bis zur Eisengruppe von +III auf +VIII (Eisen kann kann nur +VI und ist dabei unglücklich, aber Ruthenium und Osmium sind gerne achtwertig).
- die schweren Übergangsmetalle (auch Ti, V) liegen gerne in ihrer maximalen Oxidationszahl vor, z.B. TiO₂, NbCl₅, WO₃, ReF₇ und OsO₄.
Dafür gibt es keine richtigen Regeln, eher grobe Faustformeln, mit vielen Ausnahmen.
Sie 'stammen' von den Erdalkalimetallen ab, weshalb viele in der 4. Periode zweiwertig vorkommen.
Fast immer entspricht die höchste OxStufe auch der NebengruppenNr. Ausnahmen sind zB Kuper (+II) und Gold (+III).
Die NebengruppenMetalle der Perioden 5 und 6 bevorzugen die höheren OxStufen.
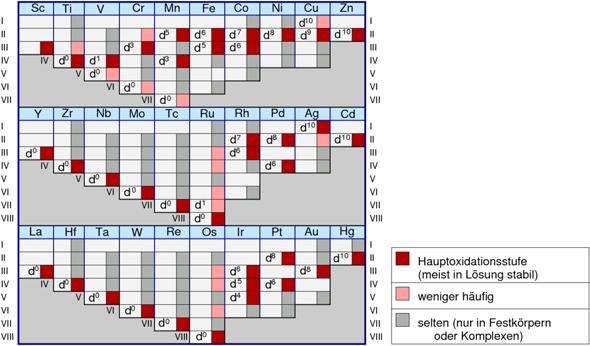
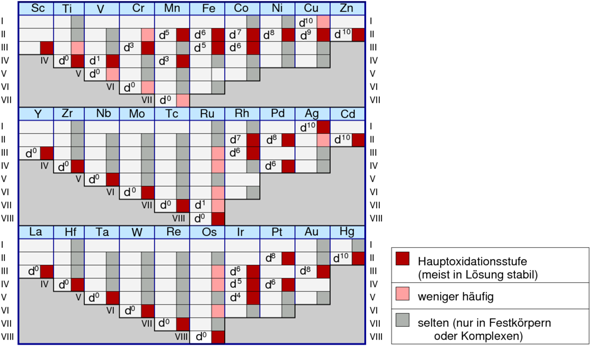
Joar, fand ich auch, als ich sie mal, vor ein paar Jahren gefunden hab. Hab sie gleich wieder gefunden.
Hübsche Graphik!