Was ist die Freie- und Gesamtalkalität bei der Laugenkonzentrationmessung?
Hallo liebe Chemiker.
Frage steht oben, hier noch das Verfahren:
· 10 ml der Laugenlösung in 100 ml Erlenmeyerkolben · Lösung mit 2 – 3 Tropfen Phenolphtalein versetzen · mit 0,1 mol Salzsäure titrieren bis Farbumschlag von violett zu durchsichtig · verbrauchte Menge Salzsäure an Messbürette ablesen (p-Wert = freie Alkalität) · die Lösung mit 2 – 3 Tropfen Methylorange versetzen · titrieren bis Farbumschlag zwiebelfarbig, Wert ablesen · verbrauchte Menge Salzsäure an Messbürette ablesen (m-Wert = Gesamtalkalität)
((p-Wert x 2) - m-Wert) x 0,04 = Konzentration in % Lauge
Übrigens, wieso muss man den p-Wert mal zwei nehmen und mit dem m-Wert subtrahieren (bei der Formel)???
Danke für hilfreiche Antworten!
3 Antworten
Ha, meine Kristallkugel wird klar: Vielleicht titrierst Du eine mit Carbonat verseuchte NaOH? Das kommt vor, wenn die NaOH an der Luft steht und CO₂ absorbiert, nach
2 OH⁻ + CO₂ ⟶ H₂O + CO₃⁻
Ein CO₂-Molekül verbraucht bei dieser Reaktion also 2 OH⁻-Ionen.
Nehmen wir an, Du titrierst eine 0.1 mol/l NaOH (10 ml, verdünnt auf 50 ml im Titrierkolben) mit 0.1 mol/l HCl. Deine NaOH hat aber leider 0.01 mol/l CO₂ absorbiert (was lt. Reaktionsgleichung 0.02 mol/l NaOH bindet), folglich ist sie in der Realität eine Mischung aus 0.08 mol/l NaOH plus 0.01 mol/l Na₂CO₃.
Im ersten Schritt titriert Du bis zum Umschlag des Phenolphthaleins bei etwa pH 9. Damit hast Du zwei Spezies, die Du gleichzeitig titrierst:
OH⁻ + H₃O⁺ ⟶ 2 H₂O
CO₃²⁻ + H₃O⁺ ⟶ HCO₃⁻ + H₂O
Für den Umschlag brauchst Du 9 ml Maßlösung: 8 ml für die NaOH und 1 ml für das Na₂CO₃. Das ist Dein p=9 ml.
Jetzt titrierst Du weiter Da Deine Probe 0.01 mol/l Na₂CO₃ enthält, verbrauchst Du einen weiteren Milliliter (Dein m=10 ml) bis zum zweiten Endpunkt, der mit Methylorange angezeigt wird, bei etwa pH 4. Die Reaktion ist
HCO₃⁻ + H₃O⁺ ⟶ 2 H₂O + CO₂
Was bedeutet aber Dein 2·p − m = 8 ml? Das ist genau der Verbrauch, der auf die echte NaOH zurückzuführen ist (0.08 mol/l), ohne das ebenfalls vorhandene Na₂CO₃. Experimentell läßt sich das nicht bestimmen, deshalb muß man es rausrechnen. Der komische Faktor 0.4 rechnet das wahrscheinlich auf Konzentration um, da stecken dann Deine Aliquote und die Konzentration der Maßlösung drin. Der ganze Ausdruck 0.4·(2ṗ−m) ist also vermutlich die Stoffmengenkonzentration (keine %) der echten NaOH.
Das p ist also proportional zur Summe aus den Stoffmengen bzw. Konzentrationen von NaOH und Na₂CO₃. Das m ist proportional zur Summe aus NaOH plus zwei mal Na₂CO₃; die Differenz m−p (1 ml in meinem Beispiel) ist proportional zur Konzentration/Stoffmenge von Na₂CO₃. Und 2·p−m ist proportional zur NaOH ( = p − (m−p)).
Damit das klarer wird, hänge ich eine berechnete Titrationskurve für mein Beispiel als Bild an. Die schwarze Kurve ist der pH-Wert in Abhängigkeit vom Verbrauch, die Äquivalenzpunkte sieht man in den weißen Kurven (1. Ableitung) als Minima.
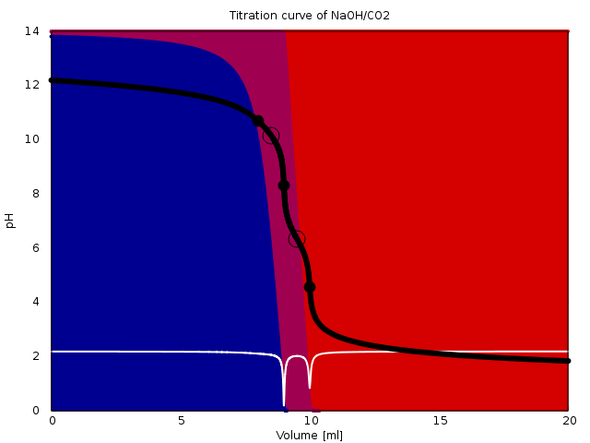
Die Natronlauge nimmt durch die Luft CO2 auf.
Ich nehme an, daß das das Thema Deiner Arbeit ist. Aber erinnere Dich: Das ist meine Vermutung, nach der fragmentarischen Beschreibung die Du hier gegeben hast. Vielleicht hast Du ja auch etwas ganz anderes gemacht.
Was Du schreibst, ist eine richtige Zusammenfassung — nur das Wort Pufferkapazität ist falsch (das ist was ziemlich anderes), Du kannst Laugengehalt oder Neutralisationsäquivalent oder so was ähnliches sagen.
Bei den 0.04 sehe ich nicht wirklich durch. Ich würde einfach 2p−m nehmen (p und m sind Volumina, also 2p−m auch) und es das „um Carbonat korrigierte Titrationsvolumen“ nennen. Daraus kann man dann ausrechnen, was man will, z.B. die Konzentration oder irgendeine Größe, die das Ausmaß der Carbonat-Kontamination beschreibt.
0.04·(2p−m) müßte eigentlich auch ein Volumen sein; vermutlich hat der Faktor 0.04 in Wahrheit eine Einheit, die Du nicht dazugeschrieben hast.
Kleine Verständnisfrage: Wie wären die p- und m-Werte, wenn die NaOH (a) völlig sauber, also CO₂-frei wäre? (b) die NaOH die maximale Menge CO₂ aufgenommen hätte, also reines Na₂CO₃ wäre?
Aber wenn ich die NaOH mit "normalem Wasser" verdünne, nimmt die NaOH auch schon Hydrogencarbonate auf, oder?
Wasser enthält (wenn es nicht gereinigt und danach penibel luftdicht verschlossen gelagert und gezapft wird) immer CO₂. Das gilt für Leitungswassser ebenso wie für dreifach destilliertes. Allerdings sind die Mengen sehr klein und für die Volumetrie eher zu vernachlässigen, weil die Löslichkeit von CO₂ in H₂O überschaubar ist.
NaOH-Lösung aber schlüft CO₂ wie ein Alkoholiker die Brandybottle. Das beginnt bereits beim Herstellen der Lösung. Und in einer Bürette läßt sich der Luftzutritt nicht so ohne weiteres vermeiden, weil man ja Druckausgleich braucht.
Ehrlich gesagt fange ich mit der Beschreibung nicht allzu viel an. Vermutlich hast Du zwei verschiedene Basen in Deiner Suppe, vielleicht NaOH und NH₃, aber dann kann ich den Faktor zwei auch nicht wirklich erklären. Genauso wenig wie das 0.04 (hat vermutlich etwas mit Deinen Probenaliquoten und der Konzentration der Maßlösung zu tun).
Was für eine Art Probe titrierst Du? Womit titrierst Du? Wie bereitest Du die Probe vor?
Die Formel lautet richtig (( p-wert x2) - m-wert) x 0,04
Also ich habe das jetzt so verstanden:
Die Natronlauge nimmt durch die Luft CO2 auf.
Bei der Titration misst man bis zum p-Wert die Pufferkapazität der NaOH. Außerdem entsteht währenddessen aus CO2 Hydrogencarbonate, die ebenfalls bis zum Umschlagspunkt
gemessen werden. Da bei der Titration als Nebenprodukt Wasser und Kohlensäure entsteht, sinkt der pH-Wert.
Bis zum m-Wert misst man die Pufferkapazität von der NaOH und von den Hydrogencarbonaten zweimal, weiter bis zum Äquivalenzpunkt. Dies macht man aus dem Grund, um die tatsächliche NaOH-Konzentration zu ermitteln, da die Hydrogencarbonate, die während der Titration entstehen, zu einem falschen Messergebnis führen würden → Dafür gibt man die Titerwerte in die Formel ein:
((p x 2)- m) x 0,04
Die Hydrogencarbonate heben sich bei der Formel auf, sodass man die „echte“ Konzentration der NaOH hat.
Die 0,04 setzt sich aus der molaren Masse von der NaOH und der Salzsäure zusammen.
Richtig????