Warum ist Methylorange bei pH=2 rot und bei pH=13 gelborange?
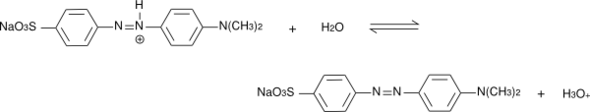
Methylorange hat bei pH=2 eine rote Farbe und bei pH=13 eine gelborange Farbe. Daraus kann man schließen, dass bei pH=2 Grün und bei pH=13 Blau absorbiert wird. Da Blau kurzwelligeres und somit energiereicheres Licht ist, müsste das delokalisierte Elektronensystem also bei pH=13 kleiner sein als bei pH=2.
Jedoch versteh ich nicht wieso dies der Fall ist.
Zwar findet im basischen Milieu zu einer mesomeren Grenzstruktur eine Ladungstrennung statt, aber das Chromophor müsste ja theoretisch auch größer werden, da ohne das Protonen am Stickstoff auch die SO3- Gruppe mit ihrem antiauxochromen (-M) Effekt in das Elektronensystem eingebunden werden kann. Es sollte doch also hier mehr mesomere Grenzstrukturen geben.
3 Antworten
Also ich denke die Größe des pi-Systems ist bei beiden Strukturen ähnlich/gleich groß und macht hier keinen signifikanten Unterschied. Es geht um die Energetik. Die Protonierung der Azogruppe müsste aufgrund des elektronenziehenden Charakters besonders das LUMO des pi-Systems absenken/stabilisieren. Das bedeutet, dass die Absorptionsenergie sinkt und weniger energiereiches Licht absorbiert wird (=grün). Also im Sauren müsste es rot sein und das passt auch. Das ist natürlich eine recht grobe Überlegung. Das ist bei solchen Systemen natürlich sehr kompliziert. Hier kann man nicht so offensichtlich trivial sehen, warum sich das Absorptionsmaximum so verschiebt, das bedarf einer detaillierteren quantenchemischen Analyse.
SO3 kann mit oder ohne Proton an Mesomerie teilnehmen, bei Protonierung entsteht eine weitere Grenzstruktur ohne Ladungstrennung.
Ist auch nicht gemeint: Mesomerie geht durch das Ganze, ob Proton dabei ist oder nicht. Es alternieren immer Doppel und Einfachbindungen am Ende freies Paar (N(CH3)2 und Lücke (SO3)
Im Sauren sind weniger Elektronen im Pi-System.
SO3 wird aber nicht protoniert