Verlauf Titrationskurve?
Weshalb verändert sich der pH-Wert anfänglich nur schwach und um den Äquivalenzpunkt dann sehr stark?
Liegt bei der starken Säure HCl trotzdem noch genügend HCl so vor das es noch weitere H+ liefern kann und so ''puffert''?
Wäre das dann bei starker Verdünnung anders?
2 Antworten
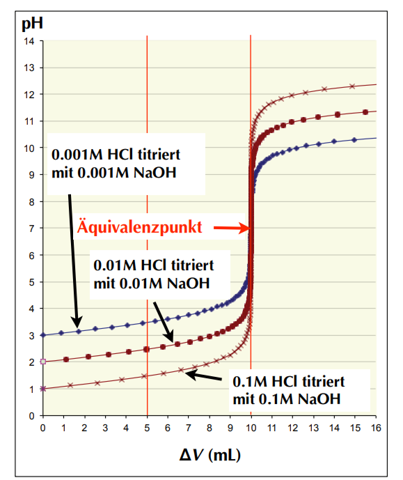
So sieht die Graphik fortgesetzt mit c= 1 mol/l bis 10⁻⁶ mol/l aus:

Wenn die Konzentrationen von Probe (HCl) und Maßlösung (NaOH) gleichermaßen c=10⁻ˣ mol/l beträgt und 10 ml Probevolumen vorgelegt werden, dann treffen die folgenden Aussagen alle zu:
- Bei V=0 beträgt der pH-Wert (starke Säure) einfach pH=−lg(c)=x
- Bei V=10 ml reagiert die Lösung neutral, pH=7, weil ja eine Lösung von NaCl vorliegt, die konzentrationsunabhängig immer neural reagiert.
- Bei weiterer Zugabe von NaOH-Lösung konvergiert der pH zum pH der reinen Maßlösung, also pH=14+lg(c)=14−x
- Bei 20 ml Verbrauch hat man eine NaOH der Konzentration ⅓c, denn man hat insgesamt 30 ml im Kolben, und die Hälfte der zugegebenen NaOH wurde wegneutralisiert, also beträgt der pH = 14+lg(⅓c) = 14+lg(⅓)−x = 14−lg(3)−x ≈ 13.5−x. Man ist also noch ca. 0.5 pH-Einheiten vom pH der reinen Maßlösung entfernt.
- Die Höhe des Sprunges am Äquivalenzpunkt nimmt also mit x ab; wennn Probe- und Maßlösung beide sehr verdünnt sind, werden sie ja vom pH her immer neutraler, und es bleibt weniger „Platz“ für einen Spung. Die Sprunghöhe, je nachdem wie man sie genau messen will, ist wenige pH-Einheiten kleiner als 14−2x.
Das kannst Du Dir übrigens leicht selber ausrechnen, denn für die Titrationskurve einer starken Säure mit einer starken Base gibt es eine recht einfache Formel:

Darin sind c₀ und V₀ Konzentration und Volumen der Probe, und c und V sind Konzentration und Volumen der Maßlösung. Die entsprechende Gleichung für eine schwache Säure mit NaOH gibt es übrigens auch, aber sie ist ein schönes Eck unangenehmer.
Liegt bei der starken Säure HCl trotzdem noch genügend HCl so vor das es noch weitere H+ liefern kann und so ''puffert''?
Die Frage verstehe ich nicht.


Gern geschehen. Wenn Du noch Nachfragen stellen willst, dann stehe ich natürlich zur Verfügung.
Wie kann ich denn generell aus der Titrationskurve den pks Wert bestimmen sowohl für starke Säuren als auch wenn schwache Säuren titriert werden?
Für hinreichend schwache Säuren siehst Du den pKₐ am Halbäquivalenzpunkt, für mittelstarke Säuren ist er nicht leicht zu finden, und für starke gar nicht.
Das hat mit der Logharithmischen Darstellung, bzw. dem pH-Wert als dekadischer Log Funktion zu tun.
Steht aber in jedem Schulbuch gut erklärt. Zur Not einfach googeln.
m.f.G.
anwesende
Ich schaue es mir noch an, chemisch interessiert es mich aber, da die base unterschiedlich aufgenommen wird und Wirkungen hat
Danke für die ausführliche Antwort!