Titrationskurve?
Ich habe hier eine Titrationskurve und verstehe nicht wie ich den pH Wert am Punkt b bestimmen kann? b würde doch dem pKS entsprechen bzw ist im Pufferbereich? Wenn ich mit nicht täusche ist HCl eine starke Säure.
c=7.0 weil starke Säure
a=pH von HCl = 0.5
Hätte ich behauptet. :)

1 Antwort
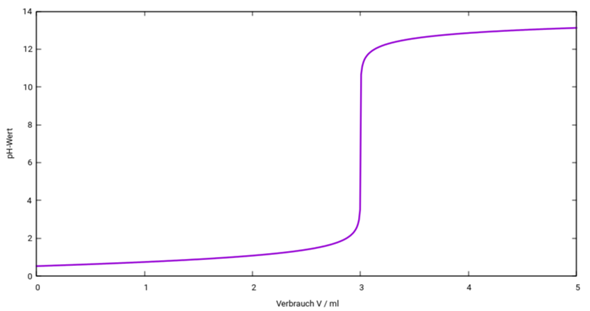
So sieht Deine Titrationskurve aus:
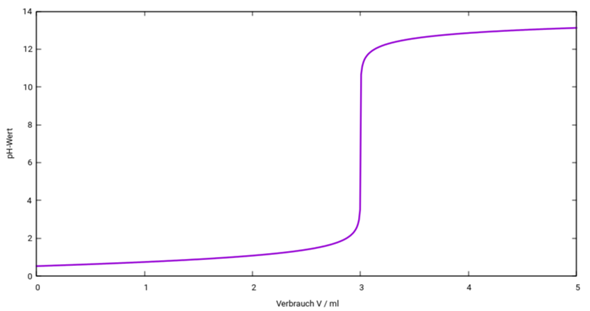
Die Steigung am Äquivalenzpunkt ist extrem steil (etwa 167000 pH-Einheiten pro Milliliter), viel steiler als in Deiner Skizze.
Bei V=0 haben wir einfach eine 0.3 mol/l HCl, also pH=−lg(c)=0.52.
Bei V=3 ml haben wir einfach eine NaCl-Lösung, die ist neutral (pH=7).
Bei V=2.5 ml muß eine eine Spur mehr rechnen. Im Titrierkolben sind vor Beginn der Titration n₀ = c₀V₀ = 0.3 mol/l ⋅ 10 ml= 3 mmol HCl enthalten. Dazu schüttest Du eine bestimmte Stoffmenge NaOH, nämlich n = cV = 1 mol/l ⋅ 2.5 ml = 2.5 mmol. Die neutralisieren Dir 2.5 mmol HCl weg, also bleiben 0.5 mmol HCl übrig, die in V₀+V = 12.5 ml Lösung leben, also ist die Konzentration 0.5 mmol / 12.5 ml =0.04 mol/l und der pH entsprechend 1.40.
Nach diesem Schema kannst Du Dir den pH-Wert an jeder Stelle der Kurve vor dem Äquivalenzpunkt ausrechnen. Nach dem Äquivalenzpunkt geht es fast genauso, nur daß dort nach der Neutralisation nicht HCl übrigbleibt, sondern NaOH, deren pH Du dann ausrechnen mußt. Alternativ kannst Du auch in diese Formel einsetzen:
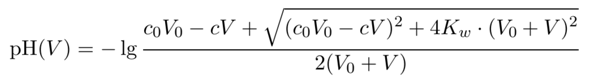
Dabei sind c₀ und V₀ Konzentration und Volumen der HCl, c und V gehören zur NaOH, und Kw=10¯¹⁴ mol²/l² ist die Autoprotolysekonstante des Wassers.
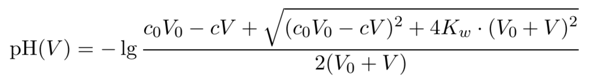
- Vielen Dank für die ausführliche und verständliche Erklärung! :)
- Nur um nochmal sicher zu gehen, ist es allgemein gültig dass bei V=0 (bzw Punkt a bei mir) 0.1 mol/L vorliegen? Ich dachte nämlich man muss von den 0.3 mol/L ausgehen?
Du hast recht, ich habe die Zahlen für V=0 verwechselt, es sind 0.3 mol/l bzw. pH=0.52. Das sieht man ja auch korrekt an der Kurve.
Ahh passt danke!
Ich hätte noch die Frage "Wie viel ml der NaOH Lösung wurden am Punkt c zugegeben?". Mein Ergebnis wären 3ml, aber ich bin mir absolut nicht sicher ob das stimmt.
Am Äquivalenzpunkt müssen die Stoffmengen übereinstimmen. Am Anfang waren n=cV=3 mmol HCl im Kolben, also tritt der Äquivalenzpunkt nach Zugabe von 3 ml NaOH ein (3 ml ⋅ 1 mol/l = 3 mmol).
Ah super danke! Mein Gedankengang war korrekt :D