Schwefeldioxid Lewis-Formel?
Laut dem Internet ist die Lewis-Formel für Schwefeldioxid wie auf dem Bild. Ich verstehe aber nicht warum. Denn so hat Sauerstoff doch jeweils nur vier Valenzelektronen. Kann mir das jemand erklären?
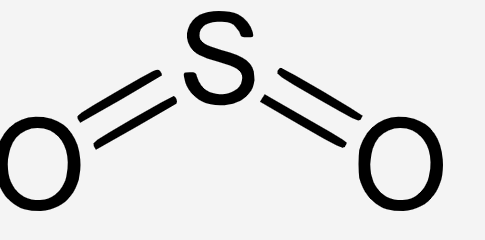
3 Antworten
Man hat die äußeren Elektronen nicht eingezeichnet :) Kompletterweise sähe das dann so aus:
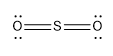
Stimmt, habe ich ausgelassen, da es nicht Bestandteil der Frage war :)
Nein, hat es nicht, die anderen Elektronen siehst du nur nicht, da sie nicht in die Bindung involviert sind
Aber bei der Lewisformel von z.B. Kohlenstoffdioxid werden die freien Elektronen doch auch angegeben, oder ist das was anderes?
Das ist was anderes, da die Elektronen halt nicht mit eingebunden werden. Es sind freie Elektronen und werden somit nicht angezeigt
Freie Elektronenpaare kann man einzeichnen, muss man aber nicht unbedingt. Ob man sie einzeichnet, richtet sich auch nach dem Zielpublikum. Ein Fachmann wird die 2 freien Elektronenpaare am Sauerstoff automatisch ergänzen.
Beim SO₂ sollte man zumindest das freie Elektronenpaar am Schwefel mitzeichnen, denn sonst erklärt sich die Winkelstruktur des Moleküls nicht.
Naja, fast. Am S ist noch ein freies Elektronenpaar.