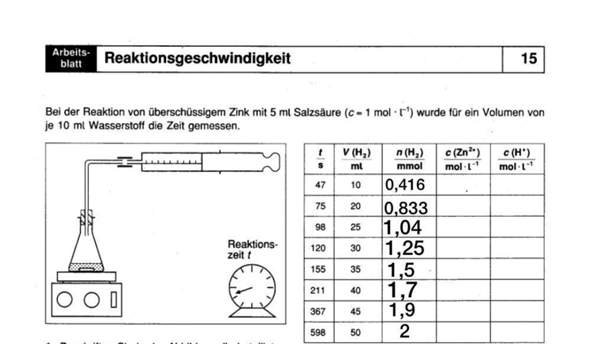
Reaktionsgeschwindigkeit berechnen?
In der Tabelle Habe ich die erste spalte berechnet. Kann mir jemand vielleicht ob sagen ob das richtig ist und wie es dann weiter geht.
Danke im voraus
1 Antwort
Ja, das sieht gut aus. Offensichtlich hast du Zimmertemperatur angenommen, wobei du als molares Volumen Vm = 24 L/mol verwendet hast. Das ist OK. Der Wert bei 50 mL ist ohne Nachkommastellen, was etwas grob ist im Vergleich zu den anderen Werten.
Es fehlen aber noch 2 Spalten ...
Nimm dazu die Reaktionsgleichung zu Hilfe, um aus der Stoffmenge des Wasserstoffs die Stoffmengen der anderen Produkte zu ermitteln.
Ergänze in der Tabelle eine erste Zeile mit t = 0s, c(Zn2+) = 0 mol/L und
c(H+) = 1 mol/L (Anfangskonzentration).
Aus der Reaktionsgleichung folgt durch Vergleich der stöchiometrischen Faktoren (Zahlen vor den Symbolen):
n(Zn2+) = n(H2). Das Volumen beträgt 5 mL. c = n/V. Beachte die Einheit beim n(H2): es sind mmol.
Für 1 mmol H2 verschwinden aber in der Lösung 2 mmol H+ von der Anfangskonzentration 1000 mmol/L. Die Umrechnung auf c ist wie oben.
Nun, die 1. Zeile wird kein Problem darstellen, sondern die Zusammenhänge der Stoffmengen aus der Reaktionsgleichung.
1 Zn + 2 H+ ---> 1 Zn2+ + 1 H2 ich habe hier die 1er ergänzt, damit es deutlicher wird.
Was bedeutet das?
z.B. ein Zn-Teilchen reagiert mit zwei H+ Teilchen zu einem Zn2+ Ion und einem H2-Molekül.
Man kann natürlich auch mehr Teilchen reagieren lassen. Geschickt ist, wenn man die Mengenangaben in Mol macht. Mol ist nur eine größere Anzahl, ähnlich wie 1 Dutzend (also 12 Stück). 1 mol ist eben 6,23*10^23 (ziemlich viel).
In deiner Tabelle hast du die Mengenangabe des Wasserstoff-Gases ausgerechnet. So ist beispielsweise nach 98 s fast genau 1 mol H2 entstanden. Dann lautet deine Reaktionsgleichung:
1 mol Zn reagiert mit 2 mol H+ zu 1 mol Zn2+ und 1 mol H2.
Das bedeutet: die Stoffmengen n von Zn, also n(Zn), n(Zn2+) und n(H2) sind immer gleich bei dieser Reaktion. Man braucht aber doppelt so viel H+ (aus der Säure).
Nun hast du n(H2) in der Tabelle gegeben. Was fehlt sind die Konzentrationen c. Formel wie oben: c = n/V. Das Volumen ist 5 mL. Das kannst du also schön einsetzen, wobei sich die Milli (m...) von mmol bzw. mL kürzen lassen (sind im Zähler und Nenner). Natürlich kannst du auch die Einheiten in mol und L umrechnen und dann einsetzen und ausrechnen.
Ist es jetzt klarer?
Das Komma sitzt falsch. 4/5 = 0,8... aber 0,4 mmol/5mL =0,0832 mol/L
gibt es vielleicht eine Formel dazu ?