pH-Wert/Dissoziation von Medikamenten?
Hallo!
Ich habe da eine Frage:
In welchen Kompartimenten wird eine schwache Base mit pKa=7,4 am ehesten vorliegen?
• Magen, pH=2
• Urin, pH=6
• Cerebrospinalflüssigkeit, pH=7,4
• Plasma, pH=7,4
• Duodenum, pH=5
Ich hätte CSflüssigkeit und Plasma angekreuzt, weil laut Henderson Hasselbalch Glg.: Wenn der pH Wert größer als der pKa ist, liegen umso mehr dissoziierte Teilchen vor. Und je dissoziierter desto eher halten sie sich in dem Kompartiment auf.
Kann mir jemand sagen ob das stimmt?
Danke im Vorhinein!
1 Antwort

Bei pH≪pKₐ ist das Zeug vollständig protoniert, bei pH≫pKₐ ist es vollständig deprotoniert, bei pH=pKₐ ist es zu 50% protoniert, bei pH=pKₐ+1 ist es 90% deprotoniert, bei pH=pKₐ+2 99% deprotoniert etc. Diese Regeln gelten immer, unabhängig von der Konzentration oder der Stärke/Schwäche der Säure
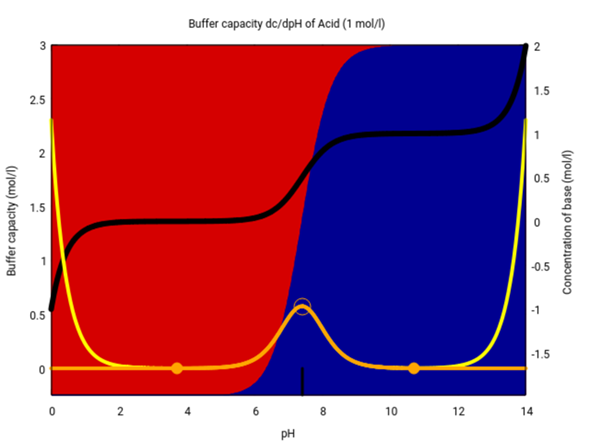
Das kann man sogar ohne große Schmerzen ≈exakt ausrechnen, und hier ist das Diagramm. Dich nteressieren dabei im wesentlichen nur die Hintergrundfarben, die geben an, zu welchem Anteil die Säureform (rot) bzw. die Baseform (blau) vorliegen, wenn der pH (x-Achse) gegeben ist.

Die gelben bzw. orangen Kurven haben etwas mit der Pufferkapazität der Lösung zu tun, und die schwarze gibt Dir an, wieviel Base Du brauchst, um ausgehend von einer 1 mol/l Lösung den pH der x-Achse zu erreichen.
Mit dieser Graphik kannst Du Dir alle Deine Fragen leicht beantworten. Du siehst z.B., daß bei pH=6 die Subsanz überwiegend in der Säureform vorliegt, mit ein paar Prozent in der Basenform.
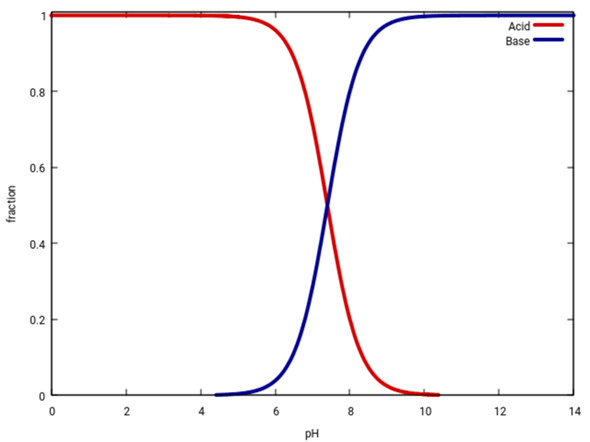
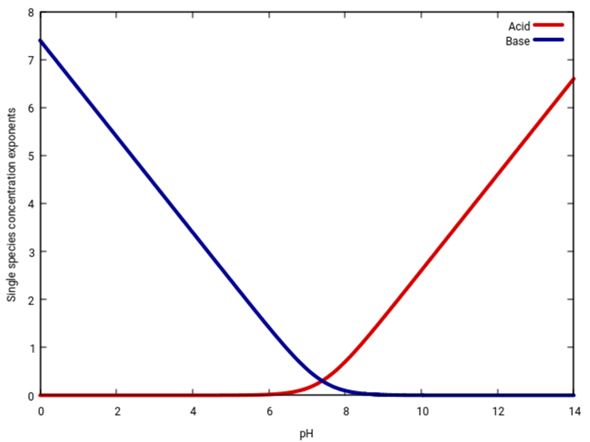
Eine einfachere Darstellung ist diese hier, die einfach de Konzentration als Funktion des pH angibt, für Säure und Base. Ich zeige es zweimal, einmal in regulären Einheiten (als Anteile), und einmal logarithmisch. An der zweiten Graphik kannst Du z.B. ableiten, daß bei pH=2 der Anteil der Basenform weniger als 10⁻⁵≈1:100000 beträgt.