pH-Berechnung?
Hi, kann mir jemand bei der folgenden Rechnung helfen? Man soll den pH-Wert berechnen…
Zu 100 ml eines Essigsäure/Acetat-Puffers mit c (HAC) = c(AC) = 0,1 mol werden 5 ml Natronlauge (1 mol • 1l) gegeben.
Mein Ansatz: no (OH-) = 1 • mol • [1. 0,005| = 0,005 mol
n (CH3COOH)= 0,01 mol + 0,005mol = 0,015mol
ich weiß nicht wie es da weitergeht…
1 Antwort
Dein Puffer enthält je n=cV=10 mmol CH₃COOH und NaCH₃CO₂, jetzt kommen noch n=cV=5 mmol NaOH dazu. Die neutralisiert die Hälfte der Essigsäure, also bleiben 5 mmol CH₃COOH übrig, und die Stoffmenge Acetat steigt auf 15 mmol.
Weiter geht es mit der Henderson-Hasselbalch=Gleichung:
pH = pKₐ + lg(Acetat/Essigsäure) = 4.75 + lg(15/5) = 5.22
Als Bonus rechnen wir dasselbe noch für beliebige Mengen an NaOH-Zugabe aus:
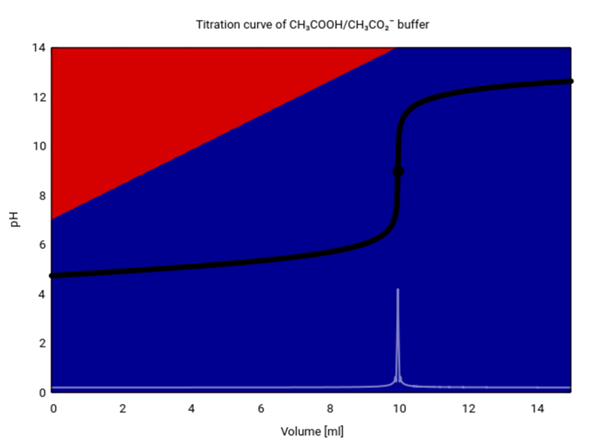
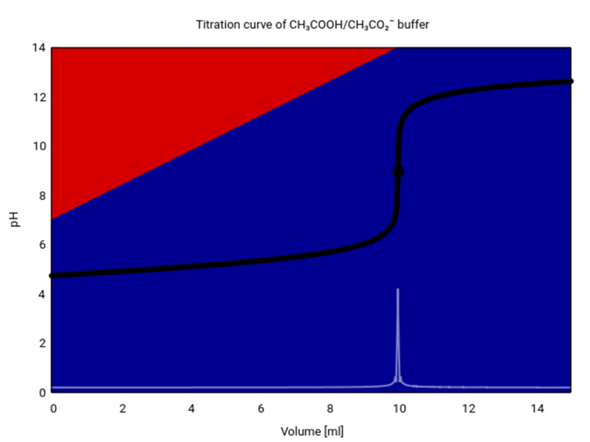
Am Startpunkt (NaOH-Zugabe = 0 ml) haben wir einen symmetrischen Puffer, der zur Hälfte aus Essigsäure (rot) und Acetat (blau) besteht und pH=pKₐ=4.75 aufweist. Je mehr NaOH wird zugeben, umso mehr Essigsäure verschwindet, und der pH steigt langsam, bis der Puffer schließlich bei 10 ml NaOH-Zugabe zusammenbricht, weil alle Essigsäure verbraucht ist. Mit der HH-Gleichung kannst Du den pH bis knapp an diesen Punkt berechnen, danach wird sie unbrauchbar
pH = pKₐ + lg [ (10+V)/(10−V) ]