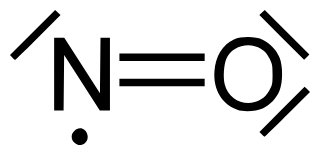Oktettregel?
Kann mir jemand die Strukturformeln für BF3, NO und NO2 aufstellen und die Abweichung von der Oktettregel erklären?
1 Antwort
Moin,
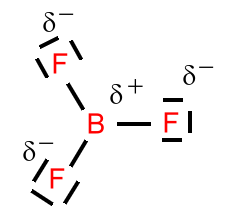
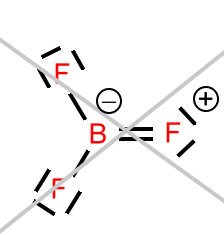
Bortrifluorid:
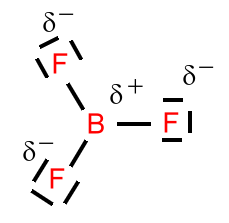
Die Struktur ist trigonal-planar. Bor erfüllt die Oktettregel nicht. Die denkbare Unterstützung durch eines der freien (nicht-bindenden) Elektronenpaare an den Fluoratomen
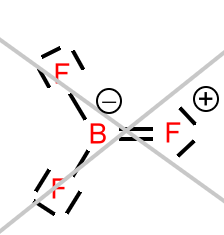
passiert eher nicht, weil die Fluoratome dazu eine viel zu große Elektronenaffinität (und infolgedessen auch Elektronegativität) besitzen, als dass sie ein Elektronenpaar in einer dativen Bindung zur Verfügung stellen würden.
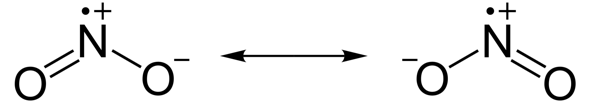
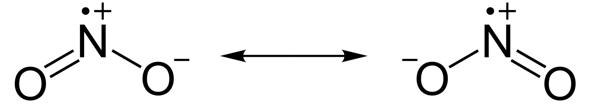
Bei den Stickstoffverbindungen entstehen mehr oder weniger stabile Radikale (Verbindungen mit ungepaarten Elektronen). Auch hier erfüllt ein Bindungspartner (diesmal der Stickstoff) die Oktettregel nicht...
Stickstoffmonoxid
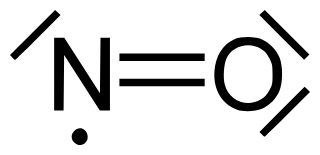
Stickstoffdioxid
Solche Radikale neigen mitunter zur Dimerisierung:
2 NO2 -----><--- N2O4
Das Ganze geht auch nur, weil Sauerstoff so gierig ist, sich zu verbinden, um seine „Oktettgelüste” zu verwirklichen. Es ist aber auch kein Wunder, dass die Bildung von Stickoxiden im Gegensatz zu sonstigen Oxidationsreaktionen endotherme Reaktionen sind.
LG von der Waterkant