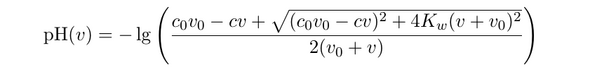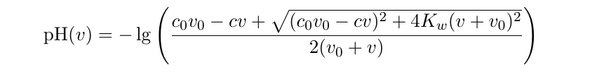Ich möchte abschätzen, wie viel HCl ich benötige um ein Gemisch aus gelösten Pflanzenproteinen aus einer alkalischen Lösung mit einer pH Absenkung auszufällen. Die unbekannte Pufferkapazität des Proteins und anderer Verbindungen in Lösung muss hierbei vernachlässigt werden. Ich habe jedoch das Gefühl, dass ich in den Berechnungen einen Logikfehler habe und möchte um eine Kontrolle meiner Rechnungen bitten.
Das Volumen der Extraktion, die gefällt werden soll beträgt 15 ml mit einer NaOH Konzentration von 100 mM. Hierfür soll das benötigte Volumen an 1 M HCl berechnet werden, dass für eine pH Absenkung benötigt wird.
Meine Überlegungen zur pH Absenkung auf pH 8:
Ich rechne mit dem pOH und der NaOH Konzentration, da für jedes Mol OH ein Mol H benötigt wird.
100 mM NaOH = 0,1 M.
pH 8 = pOH 6.
Die Differenz von 0,1 M NaOH (pOH 1) auf pOH 6 beträgt
Auf 15 ml macht das
Dann das Volumen berechnen mit
Ich muss 1,499985 ml 1 M HCl auf die 15 ml der 100 mM NaOH geben um einen pH von 8 zu erreichen.
Berechne ich das gleich statt des Ziel pH von 8 mit 9, so ergeben sich sehr ähnliche Werte, was mich stutzig macht.
pH 9 entspricht 14-9 = pOH 5. Die Differenz ist 0,09999 Mol/l (eine Zehnerpotenz weniger als bei pH 8. Rechnerisch klar, aber macht das Sinn?) Gleiche Berechung wie oben ergibt ein V(HCl) = 1,49985 ml. Das sind nur 0,135 µl weniger als auf pH 8.
Berechne ich das gleich statt des Ziel pH von 8 mit pH 3, so gehe ich folgendermaßen vor:
Da ich nicht einfach die Differenz von pH 13 auf pH 3 nehmen kann (oder doch?) berechne ich zunächst die Menge an HCl die ich zum Neutralisieren des NaOH benötige.
In 15 ml 100 mM NaOH befinden sich
Um 1,5 mmol H aus der 1 M HCl Lösung zu bekommen benötige ich V=n/C = 1,5 mmol / (1 mmol/ml) = 1,5 ml.
Dann von pH 7 auf pH 3 analog zu oben
Die pH Differenz ist 0,0009999 Mol/l.
0,0009999 Mol/l * 0,015 l = 0,0149985 mmol .
Zusammen mit der Neutralisationsmenge ergibt das
Alle berechneten Volumina zur pH Absenkung auf 9, 8 und 3 liegen sehr nahe beieinander. Stimmen die Berechnungen so? Wenn meine Rechnerei richtig ist, ist die diese so überhaubt zum Schätzen der benötigeten HCl Menge zu bebrauchen?
Schöne Grüße und vielen Dank für Eure Mühe!