Chemie Titration Äp berechnen?
A2 Skizzieren Sie den Verlauf der Titrationskurve einer Titration von 20 mL einer Propansäurelösung (c = 0, 5mol / L) p*K_{s} = 4.87 mit Natronlauge (c = 1mol / L) Bestimmen Sie dazu die pH-Werte der charakteristischen Punkte rechnerisch anhand der angegebenen Schrittfolge.
Bei mir hakt es am Äp da ich die Formel pH=14- 1 2 *(pKb -lgc0(A-) benutzen will, und jedoch keine Ahnung hab was ich für r die Konzentration von A- einsetzen muss
1 Antwort
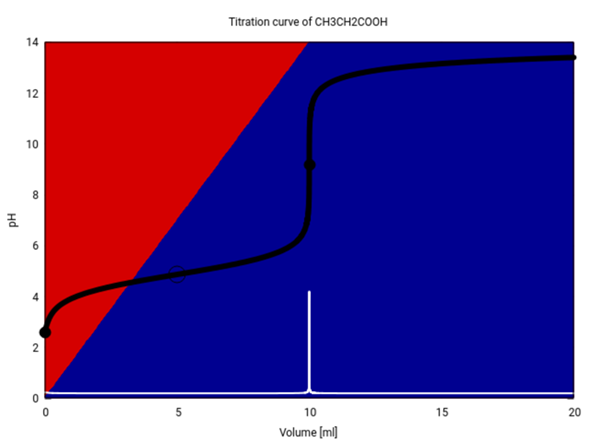
Hier ist die gesamte Titrationskurve (schwarz), ihre erste Ableitung (weiß) und die Verteilung zwischen Säure und Base im Gleichgewicht.

Wenn Du die nicht in einem Schmatz berechnen kannst oder willst, dann mußt Du für unterschiedliche Kurventeile unterschiedliche Näherungsformeln verwenden. Beispiele:
- Am Äquivalenzpunkt liegt eine Lösung von Natriumpropionat vor, also eine schwache Base. Da die ursprünglich 20 ml Probe mit 10 ml Maßlösung auf nun 30 ml verdünnt wurden, beträgt die Konzentration nur noch ⅔ des Ausgangswertes, also c=0.33 mol/l. Der pH ist dann pH = 14−pOH = 7 + ½pKₐ + ½lg(c) = 9.19
- Für den Ast V>10 ml hast Du einfach eine verdünnte NaOH-Lösung. Die NaOH-Maßlösung enthält 1 mmol/ml, aber die ersten 10 ml der Zugabe werden wegneutralisiert, also z.B. für V=15 ml verbleiben nur 5 mmol NaOH in der Lösung, deren Volumen dann 20+15=35 ml beträgt, also ist c=5⁄35=0.14 mol/l und pH=14+lg(c) = 13.15