Titration von Kohlensäure ?
Hey , ich habe eine Frage . Und zwar : bei einer Titration von Kohlensäure mit 0,1 M Natronlaugen , wo sind die Äquivalenzpunkt(e) auf der Titrationskurve? Bitte um schnelle Antwort !!
2 Antworten

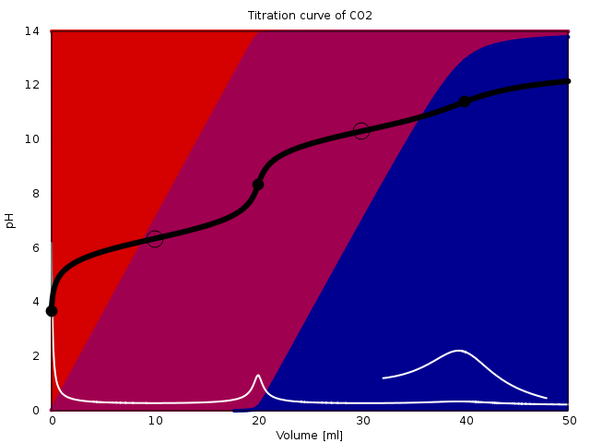
Deine Titrationskurve sollte ungefähr so aussehen wie die angehängte.
In meinem Beispiel (20 ml 0.1 mol/l CO₂ in den Titrierkolben, mit 0.1 mol/l NaOH titrieren) liegen die beiden Äquivalenzpunkte bei genau 20 und 40 ml.
Der erste Äquivalenzpunkt ist gut zu sehen, der zweite praktisch gar nicht (die weiße Kurve ist die erste Ableitung der Titrationskurve, und mit Vergrößerung sieht man den zweiten ÄP durchaus, aber praktisch ist das wertlos).

Mit Gnuplot. Die Daten stammen aus einem selbstgeschriebenen Fortran-Programm, das das Massenwirkungsgesetz für eine maximal dreiprotonige Säure lösen kann. Dazu noch ein paar Shellscripts, die das bequem laufen lassen.
Wenn Du Linuxer bist und Dich vor meinem Code (u.a. dem räudigsten Newton–Raphson aller Zeiten) nicht fürchtest, dann schreib mir Email.

Hört sich interessant an, Ich habe aber nicht mehr wirklich viel mit Programmieren am Hut. Liegt vielleicht daran, dass die Programme nie so wollten wie ich ;)

Vielen vielen Dank !
Hast du zufällig auch die genauen pH-werte der Äquivalenzpunkte ? Damit wärst du meine Rettung !

8.3440 und 11.4091. Aber diese Werte hängen auch ein bißchen von der Verdünnung im Kolben ab, da gießt man ja meist noch eine unkontrollierte Menge Wasser zu.
Der Anfangs-pH ist 3.6805 für die reine Kohlensäure. Als pKₐ-Werte habe ich 6.36 und 10.33 verwendet.

In Anlehnung an den Versuch von indiachinacook habe ich einen Schulversuch, den Du dem folgendem Link entnehmen kannst:
Mal rein interessehalber - mit welchem Programm erstellst du diese Graphen?