Chemie (Oberstufe) Färbung
Also, ich habe augaben zu bearbeiten, diese sind eine benotete Hausaufgabe und die letzten Noten in Chemie die ich wohl je haben werde, da ich in Chemie kein Abitur schreibe.^^ Jedenfalls zur Aufgabe bei der ich hilfe bräuchte:
Indigo kann auch mit Ascorbinsäure (VitaminC) reduziert werden. Dabei entsteht das wasserlösliche Leukoindigo,der Ascorbins äure bildet sich die Dehydroascorbinsäure, d.h. aus den beiden Ring - Hydroxy gruppen entstehen zwei Ketogruppen. Formulieren Sie für diese Reaktion eine Reaktionsgleichung und zeigen Sie, dass es sich hierbei um eine Redoxreaktion handelt
Indigo(C16H10N2O2)+C6H8O6 -> IndigoH2 + e
Das hatte ich mir zusammengereimt, habe jedoch wirklich keine ahnung und bitte um Hilfe.
2 Antworten
Oxidation: Ascorbinsäure --> Dehydroascorbinsäure + 2 H^+ + 2 e^-
Reduktion: Indigo + 2 e^- --> Leukoindigo
______________________________________________________
Redoxvorgang: Ascorbinsäure + Indigo --> Dehydroascorbinsäure + 2 H^+
+ Leukoindigo
Zitat: "zeigen Sie, dass es sich hierbei um eine Redoxreaktion handelt"
Betonung: zeigen Sie ...
Das ist die ultimative Aufforderung die Reaktanden als Strukturformel mit Oxidationszahlen an den wesentlichen Stellen zu notieren.
Die Redoxgleichung hat leider nicht das Potential zu zeigen, dass es sich um eine Redoxreaktion handelt, denn man kann dies nicht anhand der Namen erkennen.
Wenn man zeigen soll, dass es sich um eine Redox-Reaktion handelt, so notiert man die Oxidationszahlen der Atome an den reagierenden Gruppen. Wenn sich diese zwischen Edukt (Ausgangsstoff) und Produkt (Endprodukt) bei einigen Atomen ändert, handelt es sich um eine Redox-Reaktion und man hat dies "gezeigt"!
Dazu verwendet man eine einfache Regel, deren Hintergrund die Elektronegativität EN der Atome ist (wie stark ziehen die Atome die Elektronen der Bindung an sich). Suche eine Tabelle (nach Pauling) der Elektronegativität. Sie enthält Zahlenwerte, deren Größe ein Maß für diese Anziehungskraft ist (ohne einheit). Fluor F hat die größte EN = 4. F kann aber nur 1 Elektron aufnehmen, weil es in der 7. Hauptgruppe im Periodensystem steht. Mit einem Elektron mehr hat es Edelgaskonfiguration der Elektronenhülle und ist F-. Seine Oxidationszahl ist daher -I (minus eins):
H: ist schwach elektronegativ und verliert daher meist sein Elektron. Seine Oxidationszahl in Verbindungen ist damit +I.
Sauerstoff ist in Verbindungen meist -II
Die Summe der Oxidationszahlen hebt sich gegenseitig auf. Sind gleiche Atome miteinander verbunden, so passiert da nichts (gleich stark ziehende Bindungspartner).
Beispiel: https://www.periodni.com/de/oxidationszahlen_rechner.php?eq=ch3cooh
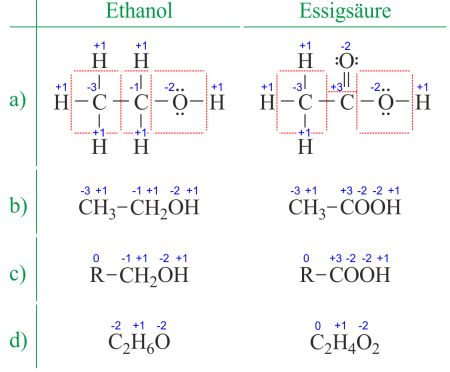
Ändern sich die Oxidationszahlen bei einer Reaktion, ist eine Redox-Reaktion abgelaufen. Notiere also die Oxidationszahlen bei der Strukturformel (oberste Zeile der Tabelle) des Ausgangsprodukts Ascorbinsäure und beim Endprodukt und markiere die Änderungen der Oxidationszahlen, dann ist die Frage beantwortet. Dort hat sich z.B. die Oxidationszahl des Kohlenstoffs am C1 von -I auf +III geändert (C1 wurde oxidiert):
Oxidationszahlen schreibt man aber als römische Zahlen mit Vorzeichen (nicht mit arabischen Zahlen, ist aber hier besser lesbar)
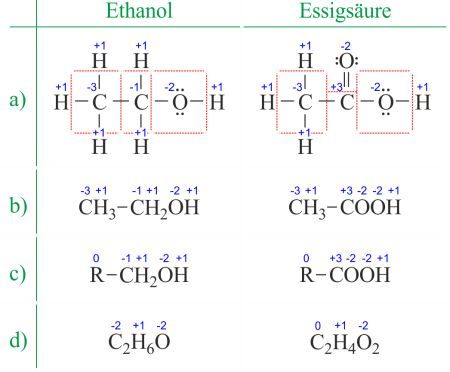
Das gibt leider keine gute Note, da nicht gezeigt wurde, dass es sich um eine Redox-Reaktion handelt.