[Chemie] Bildung von Ionen aus den Elementen?
Guten Nachmittag,
ich habe noch ein paar Fragen zum Verständnis zu der Bildung von Ionen aus den Elementen (auch bezeichnet als Salzbildung bzw. als Salzbildungsreaktion). Meine Fragen beziehen sich alle auf diese Übersicht (Beispiel):
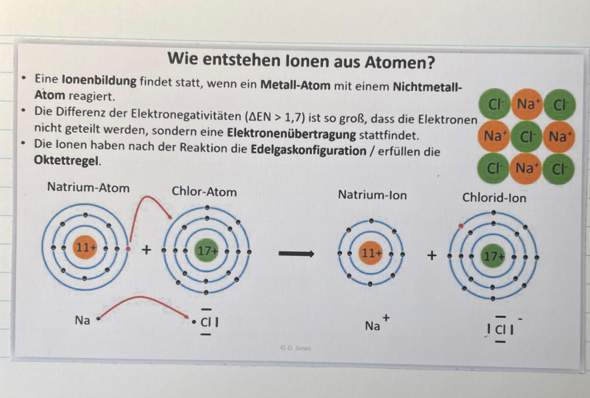
- Ganz unten wurde ja „Na“ unter dem Natrium-Atom und „Cl“ (mit der Darstellung von 7 Valenzelektronen) unter dem Chlor-Atom geschrieben. Das verstehe ich. „Na“ gibt also einen Valenzelektron an „Cl“ ab, beide werden dann zu einem Ion (Natrium-Ion und Chlorid-Ion), welche die Edelgaskonfiguration bzw. die Oktettregel erfüllen.
- Die Benennung auf der rechten Seite unten verstehe ich leider noch nicht. Wieso wird das Natrium-Ion hier nur als „Na^+“ dargestellt? (####Das hochgestellte plus verstehe ich, das schreibt man ja, da nun ein Elektron abgegeben wurde und es somit einen Überschuss von einem Proton gibt. Es gibt also ein Proton mehr als Elektronen. Daher kommt das hochgestellte plus bei „Na^+“.####) Aber wieso werden hier die Valenzelektronen bei „Na^+“ nicht dargestellt?
- Also wieso befinden sich hier keine 4 Striche um „Na^+“ drumherum?
- Ist das absichtlich so? Muss das so sein?
- Liegt das daran, dass Na (also Natrium) normalerweise 3 Schalen hat und hier nun auf der dritten Schale 0 Valenzelektronen sich befinden?
- Wird eine Schale mit 0 Elektromen, wie hier, nie gezeichnet?
- Stellt man sich die dritte Schale hierbei also im Kopf vor, um die Valenzelektronen zu zeichnen? Ist das der Grund, dass hier nur unter dem Natrium-Ion auf der rechten Seite unten nur „Na^+“ steht und drumherum keine Valenzelektronen dargestellt wurden?
Ich freue mich sehr auf eure hilfreichen Antworten.
1 Antwort
Hi,
ich versuche mal, deine Fragen zu beantworten.
Ganz unten wurde ja „Na“ unter dem Natrium-Atom und „Cl“ (mit der Darstellung von 7 Valenzelektronen) unter dem Chlor-Atom geschrieben. Das verstehe ich. „Na“ gibt also einen Valenzelektron an „Cl“ ab, beide werden dann zu einem Ion (Natrium-Ion und Chlorid-Ion), welche die Edelgaskonfiguration bzw. die Oktettregel erfüllen.
Korrekt, da hast du doch schon mal das Wichtigste verstanden. :-)
Die Benennung auf der rechten Seite unten verstehe ich leider noch nicht. Wieso wird das Natrium-Ion hier nur als „Na^+“ dargestellt? (####Das hochgestellte plus verstehe ich, das schreibt man ja, da nun ein Elektron abgegeben wurde und es somit einen Überschuss von einem Proton gibt. Es gibt also ein Proton mehr als Elektronen. Daher kommt das hochgestellte plus bei „Na^+“.####) Aber wieso werden hier die Valenzelektronen bei „Na^+“ nicht dargestellt?
Wenn Atome Elektronen abgeben oder aufnehmen, werden sie zu Ionen:
- Anionen haben die Elektronen angenommen, sind also negativ geladen (vielleicht hilft das als Eselsbrücke).
- Kationen haben die Elektronen abgegeben, sind also positiv geladen.
Natrium hat als Atom ein Valenzelektron (links dargestellt als Punkt). Es hat 11 Protonen und 11 Elektronen. Wenn es jetzt das Valenzelektron abgibt, hat es noch zehn Elektronen und elf Protonen. Also liegt ein Protonenüberschuss von einem Proton vor, weshalb das Kation dann eine einfach positive Ladung hat (Na+). Es hat auch keine Valenzelektronen mehr, weil es diese an den Reaktionspartner abgegeben hat.
Also wieso befinden sich hier keine 4 Striche um „Na^+“ drumherum? Ist das absichtlich so? Muss das so sein?
Es hat zwar ein Elektronenoktett, aber keine acht Valenzelektronen (sondern gar keine). Das sieht zwar in der Darstellung so aus, als hätte das Kation acht Valenzelektronen, aber dem ist nicht so. Bei Hauptgruppenelementen nehmen nur die Elektronen der äußersten Schale (die dem Natrium ja jetzt fehlen) an der Reaktion teil.
Liegt das daran, dass Na (also Natrium) normalerweise 3 Schalen hat und hier nun auf der dritten Schale 0 Valenzelektronen sich befinden?
Exakt.
Wird eine Schale mit 0 Elektromen, wie hier, nie gezeichnet?
Nein, wieso sollte man die auch zeichnen? Die ist ja leer. Schau dir mal den Atom- und Ionenradius von Natrium bzw. dem Kation an. Bei Natrium beträgt der Atomradius von 180 pm, das Kation einen Ionenradius von 97 pm - die letzte Schale ist nicht mehr da.
Stellt man sich die dritte Schale hierbei also im Kopf vor, um die Valenzelektronen zu zeichnen? Ist das der Grund, dass hier nur unter dem Natrium-Ion auf der rechten Seite unten nur „Na^+“ steht und drumherum keine Valenzelektronen dargestellt wurden?
Die Frage verstehe ich nicht ganz. Die dritte Schale ist beim Natriumatom da, in der ist ja das Valenzelektron. Wenn das Valenzelektron aber abgegeben wurde, gibt es keine Notwendigkeit mehr, die dritte Schale zu zeichnen - wenn man Na+ sieht und die beiden Schalen, die voll besetzt sind, weiß man, dass die dritte Schale leer ist, da da Valenzelektron abgegeben wurde. Das kann man dem Ion "ablesen", wenn man weiß, in welcher Periode und Hauptgruppe das entsprechende Element in seiner atomaren Form steht.
LG
In ein paar Minuten poste ich eine neue Frage zur Redoxreaktion/Elektronenübertragungsreaktion. :-)
Vielen lieben Dank für diese perfekte Antwort, genau so habe ich mir das auch vorgestellt. 👌🙏 Sehr hilfreich 🤩