Bedeutung der Farben im Periodensystem?
Was bedeuten die Farben?
Ich weiß nur dass ab Kalium die Elektronen anders verteilt sind.
Warum rutschen die Farben immer weiter runter bei den Nebengruppen, Lanthanoiden und Actinoiden?
3 Antworten
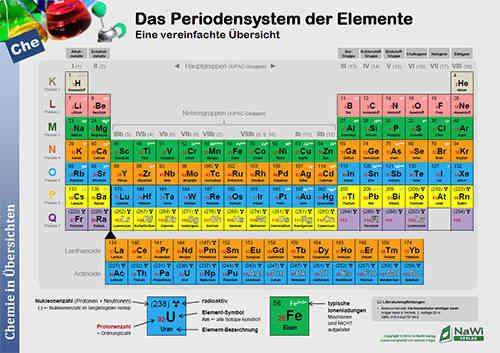
Die Farbe zeigt an, welche Schale jeweils befüllt wird. Jedenfalls nach Schema, es gibt Anomalien, die hier ignoriert werden.
- weiß = 1. Schale
- rosa = 2. Schale
- grün = 3. Schale
- orange = 4. Schale
- blau = 5. Schale
- gelb = 6. Schale
- lila = 7. Schale
Du sieht, dass bei den Übergangelementen die zweitäußerste Schale befüllt wird, bei den Lanthaniden und Actiniden die drittäußerste. Das sind die sog. d- bzw. f-Orbitale.
Das Schema heißt übrigens Madelung-Schema, findest du unter Aufbauprinzip.
Was bedeuten die Farben?
Die Farben zeigen die Valenzschalen der Atome gemäß Schalenmodell an. Also rosa für Atome mit einer L-Valenzschale, grün für eine M-Valenzschale...
Warum rutschen die Farben immer weiter runter bei den Nebengruppen, Lanthanoiden und Actinoiden?
Das ergibt sich aus dem Orbitalmodell und den Energieniveaus der Orbitale.
Das Schalenmodell ist ein Vorläufer und eine Vereinfachung des Orbitalmodells. Im Orbitalmodell wird aus der Schale und dem Energieniveau die Hauptquantenzahl: K-Schale =1, L-Schale =2, M-Schale =3...
Und als Untergruppe der Hauptquantenzahl wird die räumliche Anordnung der Orbitale mit der Nebenquantenzahl bezeichnet, welche üblicherweise mit Buchstaben geschrieben wird: s-Orbital, p-Orbital, d-Orbital...
So, und gemäß Aufbauschema werden die Elektronen "von unten" her aufgefüllt: Erst das 1s-Orbital, dann das 2s- und 2p-Orbital, dann 3s und 3p...
Tja, und bei den Nebengruppenelementen kommen jetzt d-Orbitale ins Spiel. Und da kommt eben diese schöne aufsteigende Reihenfolge der Energien nach Hauptquantenzahl durcheinander: Die d-Orbitale sind energiereicher als die s-Orbitale der nächst höheren Hauptquantenzahl. Also die 3d-Orbitale sind energiereicher als die 4s-Orbitale. Gemäß Aufbauschema werden also erst die 4s-Orbitale aufgebaut (K und Ca) und dann erstmal die 3d-Orbitale (Sc bis Zn), woraufhin dann die 4p-Orbitale aufgefüllt werden (Ga bis Kr). Eine Periode weiter werden erst die 5s-Orbitale aufgefüllt (Rb und Sr) und dann die 4d-Orbitale (Y bis Cd), worauf dann die 5p-Orbitale folgen (In bis Xe).
Deshalb hat Sc die Farbcodierung grün: Seine energiereichsten Elektronen liegen auf der M-Schale bzw. haben die Hauptquantenzahl 3, während das vorhergehende Ca als energiereichstes Elektron eines der N-Schale bzw. mit der Hauptquantenzahl 4 hat und dementsprechend orange gefärbt ist.
Bei den Lanthanoiden und Actinoiden kommen dann noch f-Orbitale obendrauf. Gleiches Spiel: La hat als energiereichstes Elektron ein N/4 Elektron und ist dementsprechend orange gefärbt, während Ba als energiereichstes Elektron ein O/6 Elektron hat, welches die gelbe Färbung bedingt.
Bildlich dargestellt sehen die Energieniveaus der Atomorbitale so aus. Jeder farbige Strich steht für ein Orbital, das ein Elektronenpaar aufnehmen kann. Beim Atom Zn mit 30 Elektronen wären beispielsweise alle 3d-Orbitale gefüllt, aber noch kein 4p-Orbital.
Ich denke das ist eine reine Veranschaulichung und hat im besonderen keine größere Relevanz.
Normal färbt man die Spalten (Senkrecht) bei den "Hauptelementgruppen" in einer Farbe ein, die Nebenelemtgruppen in einer, die Lanthanoide und Actinoide, die Übergangsmetalle und die Nichtmetalle sowie die Edelgase in verschiedenen Farben ein.
Dies soll eine "Verwandtschaft" zwischen Elementen mit ähnlichen Eigenschaften zeigen, was jedoch nicht allgemeingültig und zumeist dem Thema des Ersteller des PSE unterliegt.
Das hier hat finde ich eine schöne und sinnvolle Einteilung, was die Farben angeht, jedoch braucht man das in der Praxis eigentlich nie so wirklich.
In der Praxis sind die Molaren-Massen und die Elektronegativität zumeist am interessantesten.
Normal färbt man die Spalten (Senkrecht) bei den "Hauptelementgruppen" in einer Farbe ein, die Nebenelemtgruppen in einer, die Lanthanoide und Actinoide, die Übergangsmetalle und die Nichtmetalle sowie die Edelgase in verschiedenen Farben ein.
Nein, das ist nicht "normal", sondern eine Vereinfachung.
Ich denke das ist eine reine Veranschaulichung und hat im besonderen keine größere Relevanz.
Natürlich dient es der Veranschaulichung. Aber es ist nicht einfach "irgendwie hübsch eingefärbt", sondern die Veraschaulichung veranschaulicht auch etwas ;) Nämlich die Elektronenkonfiguration.
In der Praxis sind die Molaren-Massen und die Elektronegativität zumeist am interessantesten.
Nur, wenn man so einfache Chemie betreibt, dass die Elektronenkonfiguration noch völlig irrelevant ist.
Ich wünsche dir viel Spaß, das Verhalten der Nebengruppenmetalle (z.B. oft diverse Oxidationsstufen möglich, aber manche bevorzugt) allein mit molaren Massen und Elektronegativität zu erklären.
Nein ist nicht reine Veranschaulichung