Analyse von Silber(I)-oxid?
Ich lerne gerade für eine Chemieschulaufgabe aber ich hab das Thema ned ganz verstanden.Da steht zum Beispiel:
Stelle die Reaktionsgleichung zur Analyse von Silber (I)-oxid auf
Ist die Lösung
Ag2O -> 4 Ag + O2
Oder
Ag20-> Ag4 + O2
Oder was ganz anderes.
Denn ich glaub der Lehrer meinte das wir die Indices nicht verändern dürfen.
3 Stimmen
2 Antworten
Moin,
also "etwas ganz anderes" würde ich es zwar nicht nennen, aber du hast vergessen, die Reaktionsgleichung auszugleichen. In deiner Angabe
Ag2O ---> 4 Ag + O2
stimmt die Bilanz nicht, denn es sind nicht auf jeder Seite des Reaktionspfeils gleich viele von jedem Elementsymbol vorhanden.
Links hast du nur 2 x Ag (im "Ag2O"), rechts dagegen 4 x Ag. Auch hast du links nur 1 x O (im "Ag2O"), während es rechts 2 x O sind (im "O2"). Beides kannst du glücklicherweise leicht korrigieren, indem du den Faktor "2" vor die Formel des Silber-I-oxids auf der linken Seite schreibst:
2 Ag2O --[erhitzen]--> 4 Ag + O2
und schon stimmt's...
LG von der Waterkant
Ich hab mich bei der Abstimmung verklickt. Es ist die Option "Oder ganz was anderes".
Der Index (Die tiefgestellte Zahl) gibt an, wie viele Atome in einem Teilchen enthalten sind.
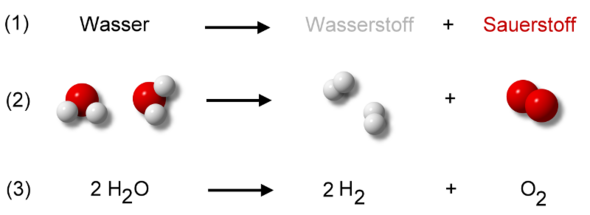
Deswegen muss die folgende Reaktionsgleichung aufgestellt werden:
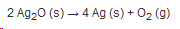
Zu erst müssen wir ausgleichen, da wir am Ende 2 Sauerstoffatome erhalten wollen, weswegen aus 2 Silber(I)-oxid-Teilchen 1 Sauerstoffmolekül hervorgeht.
Da wir 2 Silber(I)-oxid-Teilchen betrachten, gehen auch 4 einzelne Silberatome hervor.
Sauerstoff, welcher als Produkt entsteht kommt als Molekül vor, das heißt es muss eine tiefgestellte 2 sein, da ein Teilchen aus 2 Sauerstoffatomen besteht.
Bei Silber wird eine 4 vorangestellt, da wir 4 einzelne Silberatome erhalten und kein Teilchen, welches aus 4 Silberatomen besteht:
Ich hab dir im Internet noch eine passende Grafik dazu ausgesucht, welche das Ganze hoffentlich nochmals veranschaulicht:
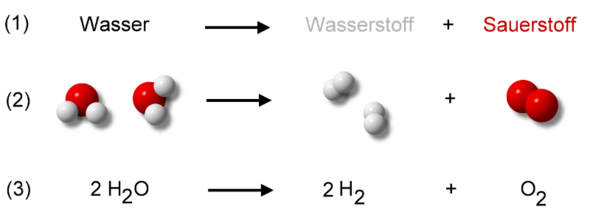
~Johannes.
Omg danke ich hab es verstanden 💫💫💫💫🔝🔝🔝🔝🔝