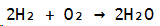Anfänglich gilt es sich einen Überblick über die Stoffmengenverhältnisse zu schaffen, welche vorliegen. Hierzu wird die Reaktionsgleichung aufgestellt.
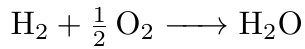
Daraus geht hervor, dass ein Mol Wasserstoff mit einem halben Mol Sauerstoff zu einem Mol Wasser reagiert. Das heißt, die Stoffmenge an Wasserstoff ist doppelt so groß, wie die Stoffmenge des eingesetzten Sauerstoffs. Dieses Verhältnis der Stoffmengen n gilt es nun in einer Gleichung darzustellen.
Für die Aufgabenstellung ist dabei nur das Stoffmengenverhältnis von Wasserstoff und Sauerstoff notwendig. Zudem gilt es den Zusammenhand zwischen Stoffmenge, Masse und Molarer Masse herzustellen, wobei die Stoffmenge der Quotient aus der Masse m und der Molaren Masse m eines Stoffes ist.
Diesen Zusammenhang gilt es nun in das obere Stoffmengenverhältnis einzusetzen.
Da nach der Masse des eingesetzten Wasserstoffs gefragt ist, muss die Gleichung entsprechend umgestellt werden.
Die Molaren Massen M der einzelnen Stoffe kann man mithilfe des Periodensystems ermitteln, wobei sich M(O) = 16.00 g/mol und M(H)=1.01 g/mol ergibt. Für die Masse des Sauerstoff geben wir dabei die vorgegebenen 10g an.
Folglich benötigen wir etwa 1.26 g Wasserstoff, damit 10g Sauerstoff vollständig zu Wasser reagieren.
~Johannes