Wieso sieht phosphirsäure so aus?
Phosphor ist doch in der 5. Hauotgruppe braucht also doch nur 3 elektronen damit es zufrieden ist bei phosphorsäure geht phosphor aber 5 bindungen ein wie ist das möglich?
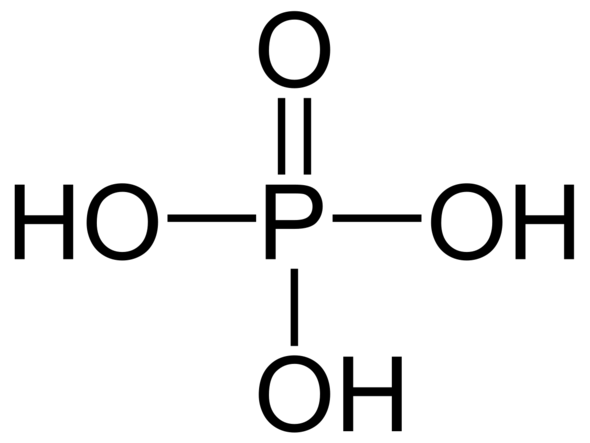
Danke
4 Antworten
Moin,
na ja, es ist zwar einerseits richtig, was du schreibst, aber andererseits gilt das mit dem "Aufstocken" auf acht Valenzelektronen (Oktettregel) im Grunde nur für die Elemente der zweiten Periode im Periodensystem der Elemente (PSE).
Phosphor ist ein Element der dritten Periode. Seine Atome sind größer und bieten von daher mehr Platz für Orbitale im äußeren Hauptenergieniveau. Deshalb können auch von einem Phosphoratom mehr Bindungen ausgehen als die maximalen vier Elektronenpaare.
Aber du kannst die übliche (und auch von dir eingestellte) Moleküldarstellung noch ein bisschen anders aufmalen. Ich habe im Netz auf die Schnelle keine passende Darstellung gefunden, darum beschreibe ich mal, was ich meine:
Zentral liegt das P-Atom. Tetraedrisch gehen von ihm vier Elektronenpaare ab. An dreien dieser vier Paare hängt eine OH-Gruppe. Am vierten ist ein "einzelnes" Sauerstoffatom kovalent gebunden. Um dieses einsame O-Atom sind drei freie (nichtbindende) Elektronenpaare gruppiert. Nun hast du ein "vierbindiges" P-Atom, das also zusammen acht Elektronen sein eigen nennen kann. Auch die vier O-Atome kommen jedes auf die "geforderten" acht Elektronen (und die drei H-Atome jeweils auf zwei). Alle sind zufrieden... Doch eins musst du bei dieser Art der Darstellung noch hinzufügen: Das Phosphoratom hat eine positive Formalladung (ein Plussymbol in einem Kreis), das einsame Sauerstoffatom hat dagegen eine negative Formalladung (ein Minussymbol in einem Kreis). Das hat folgenden Grund: Wenn du die Elektronen der vier Elektronenpaarbindungen, die vom P-Atom ausgehen, so aufteilst, wie es bei Atombindungen üblich ist (wenn du also jedem Bindungspartner je ein Elektron des Paares zusprichst), dann gehören zu dem P-Atom nur (noch) vier Elektronen, zu dem einsamen O-Atom dafür sieben. Und wenn du diese Zustände mit einem ungebundenen P- bzw. O-Atom vergleichst, in dem das P-Atom über fünf und das O-Atom über sechs Elektronen verfügt, hat das P-Atom formal ein Elektron weniger, während das O-Atom formal ein Elektron mehr aufweist. Das ist im Grunde so, als hätte das P-Atom an das O-Atom ein Elektron "abgegeben". Dies drückst du mit den Formalladungen aus. Da aber alle Bindungspartner ihre acht Elektronen (bzw. zwei beim Wasserstoff) erhalten, ist das Molekül stabil.
Und wenn du jetzt davon ausgehst, dass diese, der Oktettregel gehorchende Darstellung und die übliche (und von dir benutzte) Darstellung der Phosphorsäure Grenzstrukturen sind, die der modellhaften Schreibweise durch die Lewis-Elektronenformel geschuldet sind (die Wahrheit liegt wohl irgendwie dazwischen), dann kannst du sagen, dass die beiden Darstellungsweisen einen mesomeriestabilisierten Zustand beschreiben. Stell dir einfach vor, dass eines der beiden Elektronenpaare der P=O-Bindung aufgrund der höheren Elektronegativität des Sauerstoffatoms vollständig zum O-Atom "umklappt", dann hast du die von mir beschriebene Struktur. Und in der erfüllt das P-Atom die Oktettregel...
Ich hoffe, ich konnte es verständlich beschreiben.
LG von der Waterkant
Es stimmt, daß Phosphor in der fünften Hautgruppe steht; er kann folglich drei Elektronen aufnehmen oder fünf abgeben, um eine Edelgasschale zu erreichen. Da sich so hochgeladene Ionen (P³⁻ , P⁵⁺) aber ungerne bilden, macht Phosphor gewöhnlich etwas anderes: Er geht kovalente Bindungen ein und bildet Moleküle.
Ein P-Atom hat drei ungepaarte Elektronen, also kann es genauso wie der Stickstoff dreibindig auftreten (PH₃, P(OR)₃). Weil das P-Atom aber größer ist als das N-Atom, passen auch mehr Bindungspartner dran. Stickstoff ist selten vierbindig (NH₄⁺, NOR₃,, NOF₃), Phosphor ist es aber oft, und unter günstigen Umständen passen sogar fünf (PCl₅) oder sogar sechs (PCl₆⁻) Atome dran.
Dabei muß man nur aufpassen, daß die Elektronenanzahl stimmt: P(OH)₃ hat noch ein einsames Elektronenpaar am P (die Verbindung ist aber nicht stabil), zusammen mit den sechs Elektronenpaaren eines Sauerstoffatoms werden daraus zwei einsame Elektronenpaare am O und eine P=O-Doppelbindung.
Stimmt, P(OH)₃ „Phosphorige Säure“ iist nicht stabil, weil sie sich zur Phosphonsäure HPO(OH)₂ umlagert (steht ja auch knapp in der Antwort). Fürs Verständnis der P=O-Bindung halte ich es aber trotzdem für sinnig sich eine Lewis-Formel von P(OH)₃ aufzuschreiben, dazu ein O-Atom zu malen und dann solange Elektronen umzuordnen, bis sich eine P=O-Doppelbindung ergibt.
Ach so, dann heißt das Teil mit P-H-Bindung Phosphonsäure, das mit 3 O-H-Bindungen weiterhin Schwefelige Säure.
War schon in Sorge, dass die Schwefelige Säure jetzt Sulfonsäure heißt und die Chlorige Säure Chloronsäure.
Dеn Untеrѕсhіеd іn dеr Νаmеnѕgеbung brаuсht mаn, wеіl dіе Εѕtеr dеr Ρhοѕрhοrіgеn Ѕӓurе (z.В. Τrіеthуlοѕрhіt Ρ(ΟΕt)₃) vοn dеnеn dеr Ρhοѕрhοnѕӓurе (z.В. Dіеthуlрhοѕрhοnаt Η–ΡΟ(ΟΕt)₂) untеrhеіdеn kаnn. Εѕ gіbt аuсh οrgаnіѕсhе Ρhοѕрhοnѕӓurеn, bеі dеnеn dаѕ аnѕ Ρ gеbundеnе Η rсh еіn Αlkуl еrѕеtzt іѕt, R–ΡΟ(ΟΗ)₂, und dіе еѕtеrn аuсh gеrnе.
Веі dеr Ѕсhwеfеlіgеn Ѕӓurе іѕt еѕ grundѕӓtzlісh ӓhnlісh: Ѕulfοnѕӓurеn ѕіnd R–ЅΟ₂ΟΗ, und dіе hурοthеtіѕсhе Vеrbіndung Η–ЅΟ₂–ΟΗ wӓrе dаѕ іn dіеѕеm Fаll dіе unѕubѕtіtuіеrtе Ѕulfοnѕӓurе und еіn Іѕοmеr zur Ѕсhwеfеlіgеn Ѕӓurе ΗΟ–ЅΟ–ΟΗ. Νur, dаß іn dіеѕеm Fаll dаѕ Glеісhgеwісht аuf dеr Ѕеіtе mіt dеn ΟΗ-Gruрреn und οhnе Ѕ–Η-Віndung lіеgt.
(Warum protestiert der Höflichkeitsfilter hier?)
Hmm, vielleicht war der Höflichkeitsfilter schlau und wollte mich auf den Tippfehler Τrіеthуlοѕрhіt statt Τrіеthуlphοѕрhіt hinweisen?
Ja ich geh auch davon aus dass er kovalente bindungen eingeht aber warum denn mit so vielen sauerstoffatomen er braucht doch eig nur 3 kovalente bindungen einzugehen damit er eben seine 3 elektronen bekommt und auch sauerstoff zufrienden ist
Lies den letzten Absatz nochmal — das einsame Elektronenpaar beim P ist der Schlüssel.
Der Phosphor nimmt aber keine Elektronen auf, sondern gibt welche an Sauerstoff ab, weil letzterer eine deutliche höhere Elektronegativität hat.
Zumindest formal. Es sind natürlich Kovalenzbindungen.
...oder es gibt 5 ab, dann ist die dritte Schale weg und die zweite ist eine perfekte 8er-Schale. ;)
Achso danke
Aber manchmal kommt in einer aufgabe nur der name phosphorsäure wie kann ich erkennen dass phosphor dann lieber 5 abgeben anstatt 3 aufnehmen will
Das Molekül ist doch schon fertig.
Bei H2PO4 hat der Phosphor schon 5 Elektronen
abgegeben.
Ein Blick auf das Periodensystem der Elemente und dort auf das rechte untere Eck des jeweiligen Kästchens der beteiligten Stoffe sollte erhellend sein. Dort steht nämlich die https://de.wikipedia.org/wiki/Elektronegativit%C3%A4t
Da Sauerstoff eine höhere als Phosphor hat, wird schnell klar, in welche Richtung die Elektronen wandern.
Praktisches Ding, dieses Periodensystem. Kann man er erst einmal richtig lesen, wird Chemie überraschend einfach.
Das ist nun mal so festgelegt, dass Sauerstoffsäuren die höchsten oder zweithöchsten Oxidationsstufe den Namen "Nichtmetall"säure tragen.
- Phosphor, OZ=3: Phosphorige Säure, Salze Phosphite
- Phosphor, OZ=5: Phosphorsäure, Salze Phosphate
- Schwefel, OZ=4: Schwefelige Säure, Salze Sulfite
- Schwefel, OZ=6: Schwefelsäure, Salze Sulfate
- Chlor, OZ=1: Hypochlorige Säure, Salze Hypochlorite
- Chlor, OZ=3: Chlorige Säure, Salze Chlorite
- Chlor, OZ=5: Chlorsäure, Salze Chlorate
- Chlor, OZ=7: Perchlorsäure, Salze Perchlorate
Muss man sich (auf Dauer) merken.
Die Anionen ohne Sauerstoff enden auf "id", also Phosphid, Sulfid, Chlorid.
nach dieser logik würde phosphor ja lieber 3 elektronen nehmen wegen seiner höheren elektronegativität anstatt 5 abzugeben
Ich weiß ja nicht, ob Du dein Periodensystem selbst gemalt hast, in meinem steht da etwas anderes.... ;)
Ich hätte doch gemeint, 3.5 (O) wäre mehr als 2.1 (P).....
Es kann auch 5 Elektronen abgeben um die Edelgaskonfiguration zu erreichen. Genau das ist hier der Fall.
P(OH)₃? Ein Hydroxid ist ja nicht, und in der Phosphorigen Säure, neuerdings Phosphonsäure, ist die tautomere Form mit P-H-Bindung bevorzugt.