Wie sieht ein Hydronium-Ion (H3O+ (aq)) bzw. hydratisiertes Oxonium-Ion (H3O+) aus?
Was meine ich damit? Ich will sowas wissen wie Aufbau ...welche Ionen sind beteiligt, Bindung..., ... Es gibt leider nichts wirklich im Internet darüber.
Und hier sagen viele, dass das gleiche ist, was ja nicht sein kann, in meinem Buch steht das auch so, wie ich das gesagt habe.
Also ich wäre euch dankbar, wenn ihr mir das erklären könntet, vielleicht findet ihr auch ein Bild im Internet.
Am besten wäre es natürlich, wenn ihr das anhand von HCl in Wasser erklärt.
Da wird ja einmal Cl- und H3O+ hydratisiert
2 Antworten
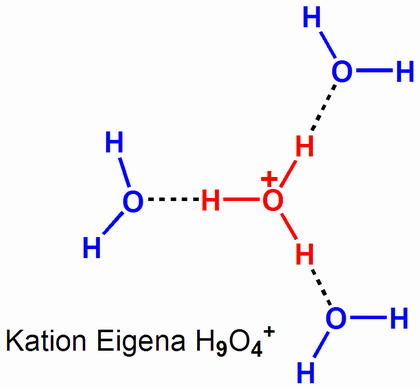
Im zeitlichen Mittel ist wohl ein H9O4+ am realistischsten.
Dabei ist das zusätzliche Proton tetraedrisch von 4 WasserMolekülen umgeben...
Beide Namen (Hydronium- / Oxonium-Ion) meinen fast das Gleiche. Es wird lediglich die Betronung auf spezielle Aspekte gelegt. Onium meint ein positives Ion. Bei Hydronium ist es das H+, bei Oxonium ist es das positive O des H3O+ -Ions. Wenn man nur das H+ bei Säure-Base-Reaktionen beachten will, sagt man also Hydronium-Ion; wenn man aber etwas besser die korrespondierenden Säure-Base-Paare im Auge behalten will, sagt man Oxonium-Ion denn die Base Wasser nimmt ein H+ auf und wird zum H3O+.
H+ kommt (außer im Weltraum als Protonensturm) nicht vor, da H+ (nur ein Proton) immer an Wasser gebunden ist. Wasser hat zwei freie Elektronenpaare, von denen eines das Proton binden kann, so dass es wie die beiden anderen Hs des Wassers am O gebunden ist. Allerdings wird durch diese Bindung die Elektronendichte am O kleiner, O wird positiv. Das ist die Ladung, die das H+ vorher hatte.
So ein (koordinativ) gebundenes H kann wie der Stab beim Staffellauf im Wasser von Molekül zu Molekül weitergegeben werden über die Wasserstoffbrückenbindungen der Wassermoleküle untereinander.
Ionen werden in Wasser natürlich hydratisiert. Damit ergibt sich ein größerer Komplex von Teilchen: