Wie geht Eisen mit Schwefel eine Reaktion ein (auf molekularer Ebene)?
Hallo,
Ich hab eine Frage zu den Elektronenverteilung bei der Reaktion von Eisen und Schwefel.
Bei der Reaktion von Schwefel und Eisen gibt Eisen zwei seiner Elektronen ab an Schwefel, so erreicht Schwefel die Edelgaskonfiguration, aber Eisen hat ja dann im d Orbital nur 6 Elektronen. Wie kann es also sein, dass Eisen dann trotzdem mit Schwefel eine Reaktion zu Eisensulfid eingeht, obwohl es eigentlich nicht "stabil" wird, weil damit eine Element der Nebengruppe stabil wir, muss das d-Orbital gar nicht , halb oder ganz besetzt sein. Irgendwie bin ich verwirrt wie es für Eisen energetisch sinnvoll ist, mit Schwefel eine Reaktion einzugehen.
Danke für die Hilfe!
2 Antworten
Man kann nicht die Einzelreaktionen für sich betrachten. Ein Sulfidion für sich ist auch weniger stabil als ein Schwefelatom. Natriumchlorid ist auch eine stabile Verbindung, obwohl die Herstellung von Na+-Ionen aus Natriummetall viel Energie erfordert. In beiden Fällen setzt die Bildung der jeweiligen Verbindung aus den Ionen viel Energie frei.
Eisen ist ein NebengruppenMetall, die in Verbindungen nur selten die OktettRegel erfüllen. Diese gilt vor allem für HauptgruppenElemente und auch nur in einfachen Verbindungen. Deshalb verwendet man sie hauptsächlich im AnfängerBereich. Wer mit d-Orbitalen argumentiert, sollte das eigentlich wissen!
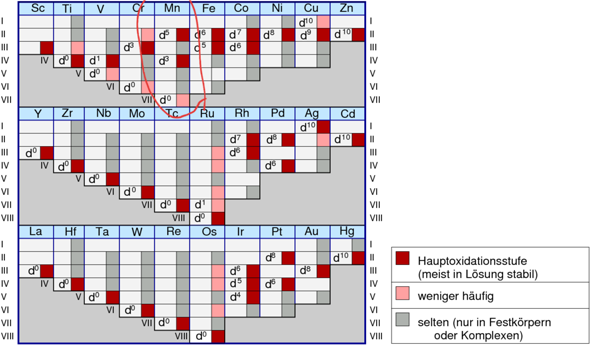
Es gibt eine 18 ElektronenRegel für Komplexe (Argon hat 18 Elektronen), aber zum 'Abzählen' ist die ungeeignet. Einfacher ist es, mit den häufigsten und maximalen OxidationsStufen zu arbeiten. ZB Mangan geht bis 7 (7. NG), hat gern aber auch 2, oder 4. Aber auch 3, 5 und 6 sind möglich.
Deshalb frag ich ja, weil die Oktetregel bei Nebengruppen nicht anzuwenden ist, wollte ich fragen, was die Begründung dafür ist, dass Eisen mit Schwefel reagiert, also ob es auch eine bestimmte Regel für Nebengruppen gibt, die ähnlich zu der Oktettregel für die Hauptgruppen ist.
und natürlich Danke