Wie gehe ich mit den Wärmekapazitäten in dieser Aufgabe um?

die lösung ist 7711KW
ich komme auch sehr nah an dieses Ergebnis allerdings nicht genau und es wird sehr wahrscheinlich daran liegen das ich mir nicht sicher bin welche Wärmekapazitäten ich nehmen muss, habe schon einiges ausprobiert.
Vielen Dank für eure hilfe

ich habe bei uns in der vorgegebenen formelsammlung diese formeln gefunden. Damit konnte ich das ganze auch berechnen, jetzt stellt sich mir aber die frage warum kann man die isobare wärmekapazität nur im offenen system anweden? Weil diese formel ja nur für enthalpie gilt und die gibt es nun mal nur im offenen system. Was wäre gewesen wenn wir Cv gegeben hätten und es ein offenes system wäre?T0 waren bei mir 273,15K
2 Antworten
Was Du wissen willst ist ja die mittlere Wärmekapazität zwischen T_1 und T_2. Gegeben hast Du aber nur die Kapazitäten zwischen T_1 und T_0 sowie T_2 und T_0.
Die Umrechnung sollte mit folgender Formel funktionieren:
Ich kriege die richtige Notation mit dem TeX Editor hier leider nicht hin, ich hoffe, es wird klar, was gemacht wird. Ne lineare Interpolation zwischen den beiden Werten.
wenn ich es richtig anwende dann würde ich für co2 einen größeren wert als 46 raus bekommen das kann aber nichts sein, also mache ich etwas falsch ?
Ah, sorry, hier ist T1 der höhere Wert. Müsste man entsprechend umdrehen.
eine frage hätte ich noch ist das ein offenes oder geschlossenes system?
Klar ein offenes System. Über die Systemgrenze Turbine tritt ja konstant ein Materiestrom (das Abgas) und mind. ein Energiestrom in Form von Wärmeverlusten.
Es tut mir leid aber ich habe noch eine Frage würde es dann heißen das ich immer ein offenes system habe sobald ich irgendeinen strom habe? Also volumen,massen,stoffmengen/-strom
ich bin mir leider immer noch sehr unsicher wie ich das erkenne.
Die aufgabe ist aber gelöst vielen dank!
Abgeschlossenes System: Nichts geht über die Systemgrenze
Geschlossenes System: Nur Energie in Form von Wärme und/oder Arbeit geht über die Systemgrenzen
Adiabatisches System: Nur Energie in Form von Arbeit geht über die Systemgrenze, Wärme verbleibt im System
Offenes System: Energie in Form von Wärme und Arbeit UND Materie gehen über die Systemgrenze
Die Antwort auf deine Frage ist also ja, sobald Du Ströme hast, die über die Systemgrenze gehen, ist es ein offenes System. Das heißt im Umkehrschluss aber nicht, dass jedes System in dem etwas strömt gleich ein offenes System ist. In einem Kältekreislauf hast Du auch Massenströme. Die verlassen aber die Systemgrenze nicht.
Dankeschön das bedeutet ja zum beispiel wenn ich eine kaffemaschine habe und die grenzen um die komplette maschine ziehe habe ich ein offenes system und wenn ich es einzelnt zum beispiel um die heizung und den wärmetauscher ziehe habe ich 2 mal ein offenes system oder nicht? Das würde nämlich für mich bedeutet man kann eigentlich alles irgendwie rechnen es kommt nur darauf an wo man die grenzen zieht und jede grenze wird seine vor und nachteile haben beim ausrechnen
die lösung ist 7711KW
ich komme auch sehr nah an dieses Ergebnis allerdings nicht genau
Zunächst mal generell zu den Wärmekapazitäten, da du dir da ja sehr unsicher bis.
Die Wärmekapazitäten sind komplizierte Funktionen der Temperatur, egal ob man sie für isobare, isochore oder bezogen auf die Stoffmenge oder die Masse bezieht. Wenn man einen Wert hat, kann man mit den bekannten Formeln die anderen drei berechnen. Die Kurven sehen für wichtige Gase so aus:
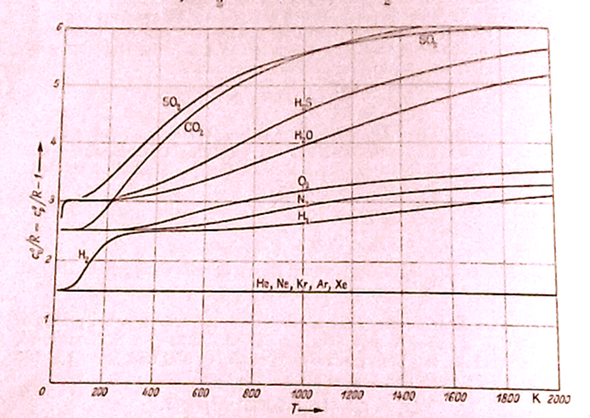
Quelle: H. D. Baehr "Thermodynamik", Springer-Verlag, 3. Auflage, 1973
In den 1960er Jahren führte H. D. Baehr die Begriffe Exergie und Anergie in die Thermodynamik ein und vollendete damit das Lehrgebäude der klassischen Thermodynamik. Daher ist seine "Thermodynamik" die Thermodynamik-Bibel schlechthin, auf die sich praktisch alle moderneren Lehrbücher oder auch Wikipediaeinträge zur klassischen Thermodynamik als Standardwerk beziehen. Selbst spätere Nobelpreisträger bezogen sich auf Baehr. Nachdem er das Standardwerk vollendet hatte, führte Baehr umfangreiche Versuche zur Bestimmung von konkreten Stoffwerten durch, die heute immer noch als Tabellen in der Anwendung sind. Und nur nebenbei: Baehr kannte ich sehr gut persönlich, da er mein Lehrer war.
Zurück zu den Wärmekapazitäten. Den verlauf der Kurven kann man aus einer Kombination von Quantenmechanik und statistischer Thermodynamik berechnen und herleiten. Man könnte sie auch je nach Bedarf integrieren, was aber aufgrund der komplizierten Formeln schon wieder eine Aufgabe für fortgeschrittene Mathematiker wäre. Das mag für theoretische Physiker alles machbar sein, für den Praktiker ist das aber gar nichts.
Daher ist Baehr hergegangen, und hat in praktischen und sehr exakten kalorimetrischen Versuchen die mittlere Wärmekapazitäten experimentell bestimmt. Als Ausgangstemperatur To hat er 0 °C gewählt. Dann wurden die Gase bis auf eine bestimmte Temperatur erwärmt und gemessen, welche Wärmemenge dafür erforderlich ist. Damit konnte man dann eine mittlere Wärmekapazität für diesen Temperaturbereich angeben, der die Integration der Temperaturfunktionen überflüssig macht. Die Ergebnisse dieser Messungen wurden als Tabellen veröffentlicht:
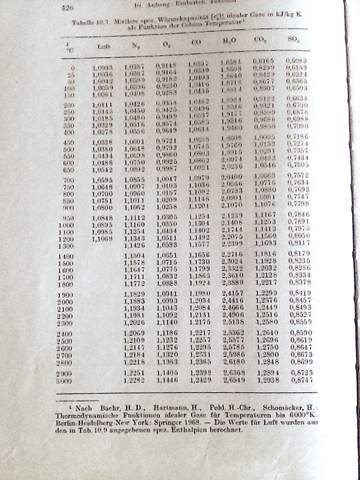
Mit diesen Werten kann man nun rechnen, als wären sie im gewählten Temperaturbereich konstant. Dass in deinen Aufgaben genau mit diesen Wärmekapazitäten gearbeitet wird, erkenn man an der typischen Schreibweise mit dem senkrechten Strich und der Angabe T1/To bzw. T2/To.
Damit ergeben sich dann folgende einfache und damit praktikable Berechnungen:
für geschlossene isochore Systeme:
∆u = u2 - u1 = cv2 * t2 - cv1 * t1
für offene Systeme:
∆h = h2 - h1 = cp2 * t2 - cp1 * t1
Bei einem Stoffgemisch wie hier in der Aufgabe, kann man die spezifischen Wärmekapazitäten entsprechend ihrer Mol- bzw. Massenanteilen aufaddieren.
Damit erhalte ich z.B.:
cp1 = (0,1 * 46,98 + 0,05 * 36,89 + 0,11 * 32,21 + 0,74 * 30,5) kJ/kmolK
= 32,66 kJ/kmolK
cp2 = 30,75 kJ/kmplK
Damit ergibt sich die vom Abgas abgegebene spezifische Enthalpie zu:
∆h = h2 - h1 = (30,75 * 247 - 32,66 * 717) kJ/kmol = -15822 kJ/kmol
und der abgegebene Enthalpiestrom ergibt sich damit zu:
∆H_punkt = m_punkt * ∆h = 0,5 kmol/s * -15822 kJ/kmol = -7911 kJ/s
Die Leistung der Turbine ergibt sich damit zu:
P = ∣∆H_punkt∣ - Hv_punkt = 7911 kJ/s - 200 kW = 7711 kW
die lösung ist von meinem professor ich bin jetzt auf 7710KW gekommen indem ich wieder mein Q_punkt01 und Q_punkt02 ausgerechnet habe und dann Q_punkt12= Q_punkt02 - Q_punkt01 gerechnet habe.
1. Also wenn ich das mit der tabelle jetzt richtig verstehe und ich würde mir einen wert bei 600°C nehmen dann wäre das meine gemittelte wärmekapazität von 0°C bis 600°C?
2.Warum kann man bei einem offenen system nur mit der isobaren wärmekapazität rechnen?
1. Also wenn ich das mit der tabelle jetzt richtig verstehe und ich würde mir einen wert bei 600°C nehmen dann wäre das meine gemittelte wärmekapazität von 0°C bis 600°C?
Richtig
2.Warum kann man bei einem offenen system nur mit der isobaren wärmekapazität rechnen?
Weil man bei einem offenen System ja nie ein geschlossenes und festes Volumen haben kann. Daher ist cv nicht anwendbar.
Hier habe ich mal etwas mehr zur Enthalpie geschrieben:
https://www.gutefrage.net/frage/enthalpie-und-entropie#answer-424230150
1. Also wenn ich das mit der tabelle jetzt richtig verstehe und ich würde mir einen wert bei 600°C nehmen dann wäre das meine gemittelte wärmekapazität von 0°C bis 600°C?
Habe meinen Fehler entdeckt, dass man Celsius- und nicht absolute Temperaturen nehmen muss und habe das entsprechend oben geändert und zack...das Publikum staunt....schon kommt die Musterlösung raus.
Ich habe folgende Tabelle in meiner Formelsammlung gegeben:
........................u2-u1 .................h2-h1
isochor: ........=Cv(T2-T1) ..........=Cp(T2-T1)
isobar:.......... =Cv(T2-T1) ..........=Cp(T2-T1)
In einem geschlossenen System gibt es doch auch die Möglichkeit, dass es isobar ist, oder nicht? Und damit müsste die Formel u2 - u1 = Cp(T2 - T1) sein, oder nicht?
Und da es im offenen System nie isochor sein kann, dürfte es dafür doch auch keine Formel geben, oder nicht?
In einem geschlossenen System gibt es doch auch die Möglichkeit, dass es isobar ist, oder nicht?
Ja, indem es eine bewegliche Systemwand gibt. Welche Wärmekapazität zu verwenden ist, ist immer so ein ziemlich verwirrendes Thema aufgrund der unzutreffenden Begrifflichkeit. Habe vorsichtshalber gerade nochmal im Thermobaehr nachgelesen und da steht:
cv ist die partielle Ableitung der inneren Energie nach der Temperatur. Aus historischen Gründen (als Wärme noch als Stoff angesehen wurde) wird cv als Wärmekapazität bei konstantem Volumen bezeichnet.
cp ist die partielle Ableitung der Enthalpie nach der Temperatur. Aus historischen Gründen (als Wärme noch als Stoff angesehen wurde) wird cp als Wärmekapazität bei konstantem Druck bezeichnet.
Insofern ist man schlau dran, wenn man das mit isochor und isobar einfach vergisst und sich merkt: bei Berechnungen der inneren Energie nimmt man cv und bei Berechnungen der Enthalpie nimmt man cp.
Bei uns in der Formelsammlung steht halt, das für einen isobaren Prozess gilt:
q12=cp(T2-T1)
Nehmen wir jetzt mal an wir haben ein isobares geschlossenes System, wo es keine Arbeit gibt nur Wärmeenergie, dann würde der 1.HS lauten: q12=u12
würde ich jetzt für q12 =cp(T2-T1) und für u12=cv(T2-T1) einsetzen hätten wir: cp(T2-T1) = cv(T2-T1) und das würde keinen sinn ergeben.
Tut mir leid, dass mir das mit dem 1 HS. noch so unklar ist, aber diese Frage schwirrt mir schon die ganze Zeit im Kopf.
Nehmen wir jetzt mal an wir haben ein isobares geschlossenes System, wo es keine Arbeit gibt nur Wärmeenergie,
Das kann es nicht geben. Wenn keine Arbeit verrichtet wird, muss es isochor sein. Dann würde aber jede Wärmezufuhr sowohl die Temperatur als auch den Druck erhöhen.
q12 =cp(T2-T1)
Diese Formel gibt es nicht. Das kann höchstens eine hergeleitete Gleichung für einen bestimmten Anwendungsfall eines offenen Systems sein.
cp(T2-T1) ist die Definition einer Enthalpiedifferenz. Die darf natürlcih nicht mit der Formel für die innere Energie u gleichgesetzt werden.
Tut mir leid, dass mir das mit dem 1 HS. noch so unklar ist,
Wie gesagt, vergiss den ganzen Blödsinn mit isochor und isobar, nimm das einfach als historische Begriffe hin. Das kommt in der Physik öfters vor. "Urknall" ist auch ein historischer Begriff, obwohl da überhaupt nichts geknallt hat, wie man heute weiß.
Merk dir einfach:
innere Energie u: cv
Enthalpie h: cp
Das komische ist halt das ich diese Aufgabe hatte:
Öl mit einem Volumen von V = 22,7dm 3 wurde von t1 = 12 °C auf t2 = 37 °C erwärmt. Die Dichte des
Öls beträgt 881 kg/m 3. Die spezifische Wärmekapazität in diesem Temperaturbereich
c p = 1884 J/(kg·K).
Bei dieser Aufgabe würde ich auf ein geschlossenes System tippen. Also müsste ich die Aufgabe doch mit Cv rechnen oder nicht? Aber bei dieser Aufgabe kommt das richtige Ergebnis mit: Q12=deltaT*Cp*20Kg=942KJ
Was dann ja dann eigentlich kein Sinn machen würde oder nicht?
Den Unterschied zwischen cv und cp gibt es nur bei idelaen Gasen. Bei Flüssigkeiten und Festkörpern, die sich kaum ausdehnen bei Erwärmung, gibt es nur eine Wärmekapazität ohne Index.
Stimmt du hast recht, habe noch eine Aufgabe gefunden, wo der Fall mit Wasser ist da hat mein Professor auch Cp genommen, obwohl es ein geschlossenes System ist und in unserer Formelsammlung steht das für inkompressible Fluide gilt: Cp ungefähr gleich Cv.
Naja wer lesen kann ist klar im Vorteil...
Also wirklich, dass war mir hier eine sehr große hilfe, langsam steige ich durch das ganze durch, wirklich ein riesen Dankeschön!!!
langsam steige ich durch das ganze durch,
Wenn man mal durchgestiegen ist, verliert Thermodynamik auch völlig ihren Schrecken. Dann wirds plötzlich ganz einfach. Das Problem ist halt, dass TD ähnlich abstrakt ist wie Mathe und zudem an den Unis neben Mathe gezielt zum Aussieben genutzt wird.
Ich muss aber wirklich sagen, das es mir auch eigentlich echt spaß macht, auch wenn manche Aufgaben es echt in sich haben. :D
Jetzt fehlen nur noch Kreisprozesse und 2.HS...
Dann meldest dud ich gegebenfalls einfach wieder. Beim Thema TD gucke ich fast täglich rein, außer wenn am Wochenende das Wetter schön ist. Dann bin ich auf dem Flugplatz. Mir scheint, bei TD bin ich auch der einzige Community-Experte.
brauch ich für diese formel denn das T0? Und wenn ja ist T0 dann 0grad celsius oder 0 Kelvin?