Wie berechne ich mol und die masse?
Bin mir nicht sicher, die letzte Spalte mit mass/g verwirrt mich total. Die Formel für number of moles wäre doch m/n , aber dafür brauch ich ja die masse die aufm pse angegeben wird? Weil hier wollen die irgendwie ein anderes mass/g idk..
4 Antworten
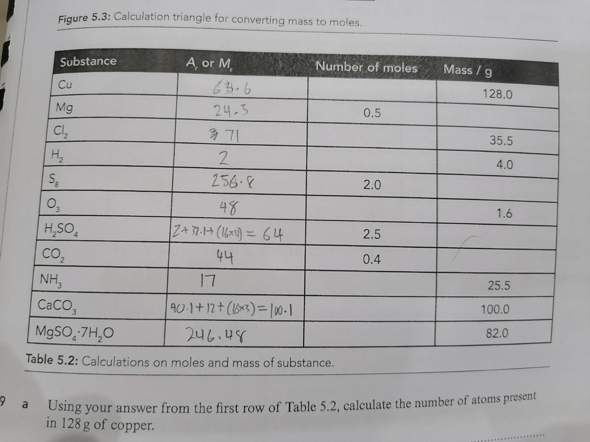
In der ersten Spalte ist das atomare oder molekulare Gewicht gefragt, welches aus einem Periodensystem zu entnehmen ist. Das Formelzeichen ist A für atomares Gewicht und M für molekulares Gewicht. Die Einheiten dieser Größe sind "u" (atomar) oder "g/mol" bei Molekülen. Beides kann aber mit "g/mol" gerechnet werden.
In der 2. Spalte wird die Stoffmenge n mit der Einheit "mol" gefragt und in der 3. Spalte die Masse m der Stoffportion in der Einheit "g".
Der Zusammenhang dieser drei Größen ist;
n = m/M oder m = n * M Einheitenformel mol = g/(g/mol) oder g = g/mol * mol
Da A bzw. M überall bekannt ist und jeweils eine der anderen Größen, kann die letzte unbekannte Größe mit der gegebenen Formel berechnet werden.
In der ersten Spalte ist die Substanz genannt, deren molare Masse oder das "Atomgewicht" in der zweiten Spalte gefragt ist. Den Teil hast Du gelöst.
In den Spalten drei und vier werden Stoffmengen und deren Gewichte gefragt. Beim Chlormolekül (Cl2) zum Beispiel wirgen 0,5mol (Spalte drei) davon 35,5g (Spalte vier).
Im Prinziep sollst Du die Lücken mit wahren Aussagen füllen, die dem jeweils vorgedruckten Wert der anderen Spalte in der anderen Maßeinheit entsprechen. Nutze jeweils die molare Masse, die Du in Spalte zwei eingetragen hast.
Ich lese das so: bei einer Msse in g (/g) von 128 (also 128 g), wie viel mol sind es da?
Gemeint ist anscheinend die molare Masse.