Welche Salze lassen sich nur schlecht in Wasser lösen?
Wir bekommen zurzeit viele Aufgaben für die Schule und müssen die auch immer abgeben. Ich bin eig auch recht gut in der Schule, aber in Chemie die komplette Niete. Dies führt mich jetzt auch zu meiner Frage.
In einer Hausaufgabe sollten wir die Lösungsernergie verschiedener Salze berechnen und benennen ob es endo- oder exotherm ist. Das hab ich auch ganz gut gelöst aber jetzt der zweiten Teil der Frage:
Stelle ein Hypothese auf, welche Salze sich nur schlecht in Wasser lösen.
Woran erkenne ich sowas? Ist das ein bestimmtes Merkmal? Wenn ja, ist das bei jedem Salz anders?
Ich füg am besten ein Bild hinzu, vllt hilft das weiter.
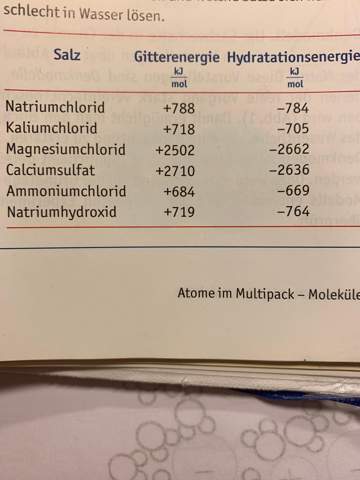
2 Antworten
Für die Löslichkeit gibt es nur ungefähre Anhaltspunkte: CaSO4 fällt durch sehr schlechte Löslichkeit auf, weil Kation und Anion doppelt geladen sind.
Ansonsten gilt: bessere Löslichkeit, wenn es exotherm und unter starker Entropiezunahme verläuft. Der zweite Faktor ist aber nur schwer abzuschätzen.
Die hydratationsenergie ist die Energie welche frei wird wen Wassermoleküle eine Ion umlagern
Ist die Hydratationsenergie größer oder gleich der gitterenergie löst sich das Salz gut, solange das Löslichkeitsprodukt nicht überschritten wird. Diese Reaktion ist exotherm, es wird also Wärme frei. Diese entsteht durch das zerstören der Kristallstruktur des Salzes.
Das gibt es natürlich auch anders rum. Ist die Hydratationsenergie kleiner als die gitterenergie, ist die Reaktion endotherm wird die Energie zum lösen des Kristallgitters der Umgebung entzogen. Auf diesem Prinzip beruhen im übrigen auch Eis-Salzmischungen um Temperaturen bis -10 grad Celsius zu erreichen.