Was ist ein Isotop und wie entsteht ein stabiles Isotop?
Ich habe das eine Ki gefragt und sie sagt: Ein Isotop ist eine Variante eines chemischen Elements, die die gleiche Anzahl von Protonen, aber eine unterschiedliche Anzahl von Neutronen im Atomkern hat. Die Protonenzahl bestimmt das Element (z.B. Kohlenstoff hat immer 6 Protonen), aber die Neutronenzahl kann variieren.
Ein stabiles Isotop entsteht, wenn das Verhältnis von Protonen zu Neutronen im Kern eine Konfiguration erreicht, die energetisch günstig und nicht radioaktiv ist. Dies bedeutet, dass es sich nicht spontan in ein anderes Element oder Isotop umwandelt. Ein stabiles Isotop hat eine ausgewogene Kernstruktur, die es vor Zerfall schützt.
Richtig?
4 Antworten
.... die Anzahl der Protonen gibt den Platz im Periodensystem der Elemente (Mendelejew) vor, also was es für ein Element es ist.
Unterschiedliche Zahlen von Neutronen bezeichnen Isotope.
Als Ergänzung würde ich auch die äußere Kernschale mit einbeziehen.
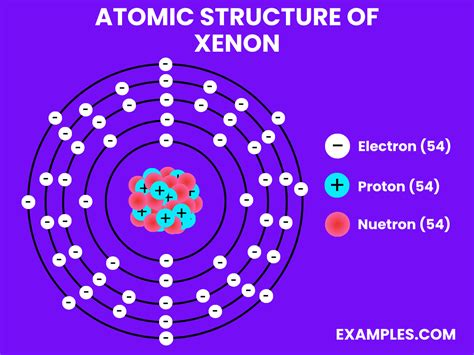
Helium oder auch Xenon (Edelgase) haben eine gefüllte äußere Schale, also eine Edelgaskonfiguration, diese Elemente sind tatsächlich stabile Isotope.

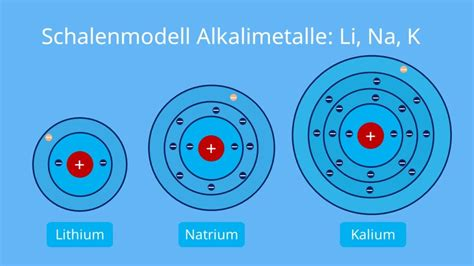
Z.B. Lithium im Vergleich hat 7 freie Plätze für Elektronen in der äußeren Schale,
das macht es so extrem reaktionsfreudig das es praktisch nie als reines Element vorkommt, sondern unmittelbar Bindungen mit was anderem eingeht und so nicht wirklich ein stabiles Isotop sein kann, siehe auch Alkalimetalle.

mfe
... vielleicht nicht, sehe eine Element auch als Isotop bei wenn Anzahl der Protonen gleich der Neutronen ist, Varianten davon sind natürlich eindeutig...
Könnte natürlich aus sein das meine Vorstellung davon dem Umstand geschuldet ist das ich in Bildern denke. ;-)
Klar, jedes Atom ist ein Isotop.
Lithium als Element ist, wie du schon gesagt hast, sehr reaktiv, dennoch sind die Isotope Lithium-6 und Lithium-7 stabil.
Nur das radioaktive Lithium-8 ist nicht stabil.
Wie schon gesagt, bezieht sich stabil bei Isotopen ausschließlich darauf, ob diese spontan zerfallen.
Auch gibt es Isotope wie Te-130 (Halbwertszeit = 2,5 * 10^21 Jahre), deren Zerfall kinetisch inert ist (sie sind also praktisch stabil), nach genauer Definition sind sie dennoch instabil (irgendwann sind sie ja zerfallen).
Danke, sehe das irgendwie von oben außen, also Physik und Chemie.
Die Punkte die Sie anführen hab ich in meinen Bildgedanken nicht drinnen gehabt,
besonders nicht weil die bezeichneten Protagonisten keine Teilchen sind sondern Wellen..., das verwirrt manchmal etwas.. ;-)
was war jetzt falsch, oder besser, was hatten Sie erwartet?
Da ich nicht ganz verstehe, was die Sätze aussagen sollen, kann ich die Frage nicht einfach mit "ja" oder "nein" beantworten. Im Großen und Ganzen ist es richtig, aber es gibt ein paar Ungenauigkeiten oder möglicherweise Unrichtigkeiten.
"Isotop" bedeutet ursprünglich "etwas, das sich am selben Ort befindet" (gemeint ist der Platz im Periodensystem der Elemente) - damit können zwei (oder mehr) Atomkerne (oder Atome mit ihren Kernen) Isotope voneinander sein, aber allein hat der Begriff keinen Sinn. Der Einfachheit halber verwendet man den Begriff "Isotop" aber auch für einzelne Atomkerne (laut Wikipedia ist der eigentlich korrekte Begriff "Nuklid").
Statt "ein stabiles Isotop entsteht" würde ich sagen "ein stabiles Isotop liegt vor" (bzw. "ein stabiler Atomkern liegt vor").
Was ist mit dem "Verhältnis von Protonen zu Neutronen" gemeint? Wenn man die Anzahlen als solche meint, stimmt es. Wenn man das Verhältnis im mathematischen Sinne meint (z. B. ebenso viele Protonen wie Neutronen), stimmt es nicht - je mehr Protonen ein Kern hat, desto mehr Neutronen pro Proton braucht er tendenziell, um stabil zu sein. (Wasserstoff hat im einfachsten Fall überhaupt kein Neutron und ist stabil; soweit ich mich erinnere, ist Stickstoff der schwerste Kern mit ungerader Prozonenzahl, bei dem ein Kern mit Protonen-Neutronen-Verhältnis 1:1 stabil ist.)
"Künstliche Intelligenzen" durchforsten riesige Datenmengen und nehmen Auswahlen und Umformungen gemäß statistischer Auswertungen und Ähnlichkeitsvergleichen vor - "Diese Art von Umformung hat in vergleichbaren Fällen fast immer zu einem richtigen Ergebnis geführt, da kann ich annehmen, dass sie auch diesmal zu einem richtigen Ergebnis führen wird". Aber von einem wirklichen Verstehen sind unsere "KI"s noch weit entfernt.
Besitzen 2 Atome eine unterschiedliche Anzahl an Protonen so handelt es sich um verschiedene Elemente.
Haben 2 Atome die gleiche Protonenanzahl, unterscheiden sich aber in der Anzahl ihrer Neutronen, so handelt es sich um 2 Isotope ("Varianten") des gleichen Elements.
Isotop:
Ein Isotop ist ein Atom mit einer anderen Anzahl an Neutronen, als die Anzahl der Protonen.
Stabiles Isotop:
Ein Isotop, welches nicht zerfällt, also stabil.
Kann durch Zerfall anderer Isotope oder Bestrahlung entstehen.
Theoretisch könnte ich zum Beispiel Kohlenstoff bestrahlen, dabei könnten stabile Isotope wie C12 oder C13 entstehen, welche nicht weiter zerfallen.
Noch Fragen?
Ein Isotop ist ein Atom mit einer anderen Anzahl an Neutronen, als die Anzahl der Protonen.
Nein, ich gehe davon aus, dass für dich die Hauptspezies kein Isotop ist (?). Zum Beispiel hat aber 108Ag 47 Protonen und 61 Neutronen.
Außerdem, was wäre in deiner Definition der Bezugspunkt?
Stattdessen müsste man das so definieren:
Besitzen 2 Atome eine unterschiedliche Anzahl an Protonen so handelt es sich um verschiedene Elemente. Haben 2 Atome die gleiche Protonenanzahl, unterscheiden sich aber in der Anzahl ihrer Neutronen, so handelt es sich um 2 Isotope des gleichen Elements.
Naja, die werden aber für die Definition von Isotopen schon irgendwie gebraucht
Was ist denn mit nur einem Isotop? Das sind zwei Isotope, oder ist ein Isotop immer 2 davon?
Kurz:
Isotope sind Atome eines Elements, die eine gleiche Anzahl von Protonen und Elektronen haben, sich jedoch in der Anzahl von Neutronen unterscheiden.
Dabei kann das Atom selbst dann instabil sein, wenn die Anzahl der Protonen gleich der Anzahl der Elektronen ist.
Der Nutzer suplol sieht alle Atome eines Elements als Isotope an, soweit sie in ihren Massenzahlen zu unterscheiden sind.
Zumindest so habe ich es verstanden.
Tatsächlich steht in keiner Definition, dass ein Atom, welches eine gleiche Anzahl an Protonen und Neutronen hat, kein Isotop ist
Genau, eine bestimmte Atomsorte (z.B. C12) wird als Nuklid bezeichnet. So sind daher C12 und F19 zwei verschiedene Nuklide, ebenso wie C12 und C13, welche aber zusätzlich isotop sind.
Reinelemente wie z.B. Fluor (F19) sind mononuklid, F19 ist aber trotzdem ein Isotop
Ein Isotop ist ein Atom mit einer anderen Anzahl an Neutronen, als die Anzahl der Protonen.
stabile Isotope wie C12
Aber C12 hat doch 6 Protonen und 6 Neutronen, wie kann das ein Isotop sein? 🤔
Die Frage ist berechtigt, wie du oben sehen kannst, haben wir dort genau das ausdiskutiert.
Warum bist du so schlau und kannst dir sowas merken?
Auf jeden Fall danke für das Kompliment, aber das ist einfach nur Schulstoff.
Auch ist es nicht schwierig nachzugoogeln, falls man sich nicht mehr sicher ist.
Zu guter Letzt, ist es einfach ein Gebiet, dass mich interessiert.
Schulstoff habe ich schon gefühlt alles vergessen
Das ist falsch. Auch ein Atomkern mit der gleichen Anzahl von Neutronen und Protonen ist ein Isotop. Isotopen sind halt alle möglichen Kombinationen von Protonen und Neutronen.
Du vertauscht hier stabiles Isotop und stabiles Element.
Ein Isotop ist stabil, wenn der Kern nicht spontan zerfällt. Mit der Reaktivität hat das allerdings nichts zu tun