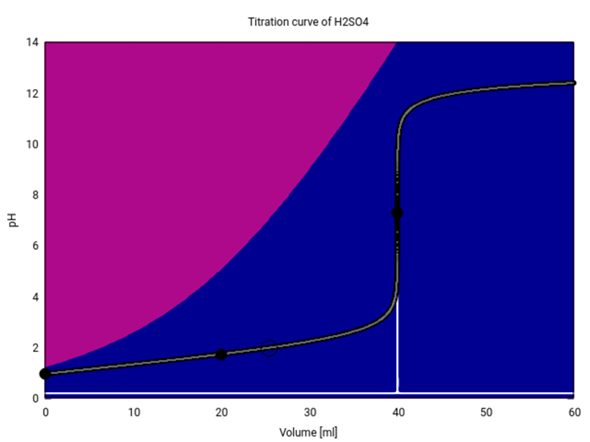
Titrationskurve von Schwefelsäure mit Natronlauge?
Hallo, ich hätte eine Frage zu der Titrationskurve von Schwefelsäure mit Natronlauge. Wieso hat diese nur einen Äquivalenpunkt, obwohl sie eine mehrprotonige Säure ist. Ich denke, dass es etwas damit zu tun hat, dass sie eine starke Säure ist. Kann mir jemand auch allgemein den Verlauf der Kurve erklären.
Vielen Dank im Voraus!😊
1 Antwort
Naja, das Hydrogenssulfat ist eine mittelstarke Säure (pKₐ=1.99), die gar nicht viel schwächer ist als die starke Schwefelsäure. Eine 0.1 mol/l H₂SO₄ hat pH=0.96, eine ebenso starke Lösung von NaHSO₄ ist mit pH=1.57 auch nicht viel weniger sauer.
Am Ausgangspunkt einer H₂SO₄-Titration liegt formal H₂SO₄ vor, am ersten Äquivalenzpunkt NaHSO₄. Wie wir gesehen haben, unterscheiden sich die beiden im pH nicht sehr (in der Praxis kommt natürlich noch Verdünnung dazu), daher hat der pH einfach keinen Spielraum zum Springen.
Hier siehst Du die Titrationskurve (20 ml 0.1 mol/l H₂SO₄ mit 0.1 mol/l NaOH). Die Hintergrundfarben verraten, welche Ionen im Gleichgewicht vorliegen:
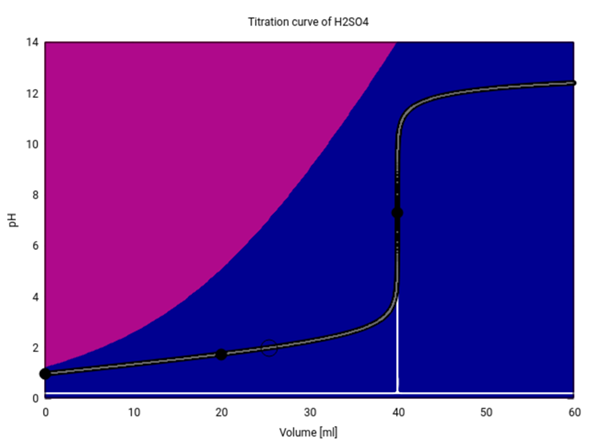
Wie wir gesehen haben, ändert sich der pH nicht sehr, wenn man vom Anfang bis zum ersten Äquivalenzpunkt (20 ml) kommt. Am Anfang besteht die Lösung hauptsächlich aus Hydrogensulfat HSO₄¯ (violett), das im Lauf der Titration immer mehr zu Sulfat (blau) deprotoniert wird. Aber ein pH-Sprung kann erst auftreten, wenn das HSO₄¯ ganz verschwindet, und das ist erst beim zweiten Äquivalenzpunkt (40 ml) der Fall.