Kann flüssiger Stickstoff auch warm werden, oder bleibt er so kalt?
Wenn man Flüssigen Stickstoff in einen Behälter gibt, der nicht nachgibt und jeden Druck Stand hält. Danach versucht man den Stickstoff aufzuwärmen. Da der Stickstoff sich nicht ausbreiten kann, muss er wohl flüssig bleiben. Heißt das, in einem geeigneten Behälter kann man Stickstoff auch auf +20 Grad aufwärmen, oder geht das nicht und der Stickstoff hält seine Temperatur konstant bei -196 Grad?
5 Antworten
Wenn man Flüssigen Stickstoff in einen Behälter gibt, der nicht nachgibt und jeden Druck Stand hält. Danach versucht man den Stickstoff aufzuwärmen
Es gibt noch eine Variable, die wichtig für das Verhalten dieses Systems ist: Nämlich wie voll der Behälter ist. Da müssen wir ein paar Fälle unterscheiden.
Zunächst ist mal eines klar: Wenn Du dem Behälter Wärme zuführst, dann muß seine innere Energie steigen. Normalerweise bedeutet das, daß die Temperatur steigt, es kann sich aber auch der Aggregatzustand ändern (eine Wasser/Eis-Mischung hat immer 0 °C; wenn Du sie erhitzt, dann hält sie ihre Temperatur, indem ein Teil des Eises schmilzt), also ein Phasenübergang auftreten. Wenn also genug Wärme in Deinen Behälter steckst, muß der Inhalt irgendwann einmal Raumtemperatur haben. Die Frage ist: Gas, Flüssigkeit oder sonstwas?
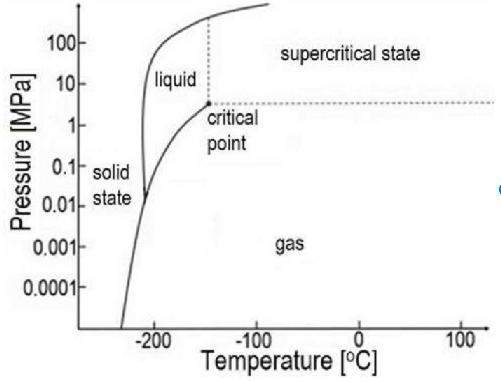
Das ist ein Phasendiagramm des Stickstoffs. Stickstoff hat bei Atmosphärendruck (0.1 MPa) eine Siedetemperatur von −196 °C, und das ist auch genau die Temperatur, die sich bei flüssigem Stickstoff automatisch einstellt. Dieses p/T-Paar liegt genau auf der Siedekurve, das ist die Kurve zwischen dem flüssigen und gasförmigen Zustand.
Nehmen wir nun an, das Gefäß sei am Anfang randvoll, also gänzlich mit Flüssigkeit gefüllt. Auch bei leichtem Erwärmen steigt der Druck enorm extrem an, weil sich der Sticki ja ausdehnen will und das nicht kann. Je nachdem, wie groß die relevanten Kenngrößen sind (nämlich die thermische Ausdehnung und die Kompressibilität, die beide Funktionen von T und p sind), bewegst Du Dich beim Erwärmen des Systems vom Startpunkt (−196 °C/0.1 MPa) also nicht nur nach rechts, sondern auch stark nach oben; wenn die erwähnten Kenngrößen es so wollen, dann könnte der Stickstoff sogar fest werden (es gibt festen Stickstoff bei 2000 K und 110 GPa, wenn Dein Gefäß das aushält). Realistischerweiser zerbirst Dein Gefäß schon vorher.
Nun nehmen wir an, daß Du nicht ganz voll füllst, sondern einen kleinen Raum mit gasförmigem N₂ darin hast. Das wird den Druckanstieg stark abmildern. Mit etwas Glück bleibt der Druck unterhalb von 1 GPa = 1000 MPa, so daß wir mit dem obigen Phasendiagramm auskommen. Solange zwei Phasen (Gas/Flüssigkeit) da sind, muß das System immer auf der Siedekurve bleiben (das ist die, die Gas und Flüssigkeit im Diagramm trennt und die im kritischen Punkt endet).
Gas ist viel kompressibler als Flüssigkeit. Wenn sich die Flüssigkeit beim Erhitzen ausdehnt, dann muß sich das Gas also zusammendrücken lassen. Wenn das Gasvolumen sehr klein ist, dann wird es sehr stark zusammengequetscht, das begünstigt aber die Kondensation: Wenn der Gasraum so stark zusammengequetscht wird, daß es dichter als die Flüssigkeit wäre, dann kondensiert es einfach und vermindert dadurch den Druck.
Das bedeutet, daß beim Erhitzen der Gasraum kleiner wird und irgendwann verschwindet. Die Temperatur und den Druck, bei dem das passiert, hängt von den Kenngrößen und dem ursprünglichen Flüssig/Gas-Verhältnis ab. Von da an gilt dasselbe wie oben: Das System biegt von der Siedekurve nach oben ab, und der Druck steigt mit dem Erhitzen ganz enorm an. Wenn der Abbiegepunkt hinreichend knapp am kritischen Punkt liegt, dann erreichst Du den superkritischen Zustand (≈ dichtes Gas, das bei isothermer Druckerhöhung zwar dichter wird, aber nie flüssig).
Nun nehmen wir an, Du erlaubst ein großes Gasvolumen im Behälter. In diesem Fall steigt der Druck im Gasraum beim Erhitzen nur moderat. Es kann ständig flüssiger Stickstoff verdampfen, bis irgendwann keiner mehr da ist. Dann biegt das System von der Siedekurve nach unten ab, und Du landest im Gasraum. Das ist der langweiligste Fall.
Es gibt nun genau ein Gas/Flüssig-Verhältnis am Anfang des Experiments, bei dem das System der Siedekurve bis zu ihrem bitteren Ende folgt, nämlich dem kritischen Punkt. Unmittelbar unterhalb des kritischen Punktes ist das Gefäß vollständig mit Flüssigkeit gefüllt, unmittelbar darüber vollständig mit superkritischem Gas, und dazwischen liegt bizarrerweise kein Phasenübergang; stattdessen treten exotische und intrinsisch chaotische Effekte wie kritische Opaleszenz auf.
Paß bitte auf, ich habe das alles vor 30 Jahren im Studium gelernt und seither nie gebraucht. Möglicherweise steckt die eine oder andere Unsauberkeit in der Erklärung drin, aber ich glaube, im großen und ganzen sollte sie stimmen.
Ich habe ja gesagt, daß das durchaus möglich ist, daß man dann festen Stickstoff bei Raumtemperatur bekommt — abhängig von Kenndaten, die ich nicht weiß, und die vielleicht überhaupt unbekannt sind.
Denn ein solches Experiment ist kaum durchzuführen. Erstens dehnt sich auch das Gefäß mit der Temperatur aus. In einer dicken gekrümmten Wand treten dabei notwendigerweise Spannungen auf, die die mechanische Belastbarkeit herabsetzen. Die auftretenden Drücke sind astronomisch, das kommt schon dem Druck im inneren Erdkern nahe. Alle Werkstoffe verhalten sich unter solchen exotischen Bedingungen anders, als man es gewohnt ist. Möglicherweise reagiert das Metall sogar mit dem Stickstoff unter Bildung irgendwelcher Nitride, die das Metall verspröden. Kurzum: Egal wie Du die Flasche baust, sie wird Dir um die Ohren fliegen.
Solche Experimente werden gewöhnlich mit einem Diamantstempel gemacht. Damit erreicht man ordentliche Drücke, aber ich habe noch nie gehört, daß man in diese eine Flüssigkeit einfüllt. Ich stelle mir das sehr schwierig vor, vermutlich würde man festen Stickstoff einfüllen, bzw. hat das getan, denn eine kubische Hochtemperaturphase von polymerem Stickstoff ist bekannt. Könnte man sie bei Raumtemperatur metastabil halten, wäre sie ein enormer Energielieferant: Bei der Umwandlung zu N₂ bei Raumtemperatur wird pro Masse fünfmal mehr Energie frei als bei militärischem Sprengstoff.
Natürlich
Wobei es auch sein kann, dass Du irgendwann, wenn die Energie hoch genug ist, keine Flüssigkeit mehr hast, stattdessen könnten die Teilchen untereinander fusionieren.
Fusion findet statt, wenn die Kombination aus Druck und Energie hoch genug ist. Du hast eine Flasche, die jedem Druck stand hält, wenn Du die Energie also beliebig hoch drehst, hast Du früher oder später Kernfusion.
So "lebt" unsere Sonne, nur, dass sie das im wesentlichen mit Wasserstoff macht, und nicht Stickstoff.
Für Stickstofffusion würde eine gewaltiger Druck und eine hohe Hitze nötig und die wäre höher auf der Sonne. Wir würden dann wahrscheinlich Eisen generieren.
Wenn die Flasche einen endlosen Druck aushält und man die Temperatur endlos erhöhen kann, hast Du irgendwann die Bedingungen erreicht.
Klar ist das sinnlos, aber es war eine unzerstörbare Flasche gegeben :D
Würde behaupten, dass der Stickstoff trotzdem verdampft und in dem Behälter einen extremen Druck aufbaut, bis dieser explodiert.
Er wird gasförmig und entweicht wenn er im Behälter erwärmt wird der geschlossenen ist wird der Behälter Bersten und durch Überdruck explodieren
Ja das geht unter Druck kann er auch bei 20 Grad sein.
Wenigstens hat einer von dreien nicht die "Kleinigkeit" überlesen, dass es um einen "idealen Druckbehälter" geht. ^^
Danke für die ausführliche Antwort. Das ist interessant.
Ich habe eigentlich gemeint, ein Gefäß, das nicht nachgibt wie z.B. ein mehrere Zentimer oder Meter dickes Gefäß aus Stahl. Wenn man das zu 100% mit flüssigem Stickstoff füllen würde und dann das Gefäß samt des flüssigen Stickstoffes aufwärmen würde auf +20 Grad. Ich denke, der Druck würde enorm steigen und dadurch würde vielleicht ein neues Element entstehen. Der Stickstoff würde dann evtl. zu einem festen Aggregatszustand übergehen ähnlich wie Wasser bei sehr hohem Druck zu Eis 7 wird.
Man kann es aber nicht genau wissen. Eis 7 gibt es hier auf der erde nicht und was mit Stickstoff passiert kann man einfach nicht genau wissen.