Eine Gasflasche (Stahl) mit einem Füllvolume von 60 Litern wird mit Stickstoff mit einem Druck von 100 bar befüllt?
Um wieviel ist die Flasche schwerer als im Leerzustand?
3 Antworten
Zustandsgleichung des "idealen" Gases
p*v=m*R*T hier p=100bar=100*10^5 Pa (Newton pro m^2)
v=60l=0,06m^3 und R=297 J/(kg*K) für Stickstoff und 0° Celsius=273,15° Kelvin
m=p*v/(R*T)=100*10^5 Pa*0,06m^3/(297 J/(kg*K)*273,15°)=7,395 kg
Hinweis: Die Masse m ist abhängig von der Temperatur in Kelvin.
Bei 15°C und 1 bar hat Stickstoff eine Dichte von 1,1694 kg/m^3
1 m^3 = 1000 l , 60 l = 0,06 m^3
Bezogen auf Umgebunsdruck sind in der Flasche V = 0,06 m^3 * 100 = 6 m^3
Damit beträgt die Masse der Flaschenfüllung m = 6 m^3 * 1,1694 kg/m^3 = 7,016 kg
Das ist das Gesetz von Boyle-Mariotte. Für ideale Gase, zu denen Stickstoff gehört, gilt bei konstanter Temperatur p * V = const.
bzw. p1 * V1 = p2 * V2
konkret:
0,06 m^3 * 100 bar = 6 m^3 * 1 bar
Also die Aufgabe ist sehr schlecht formuliert.
Herzliche Grüße,
arhimedes
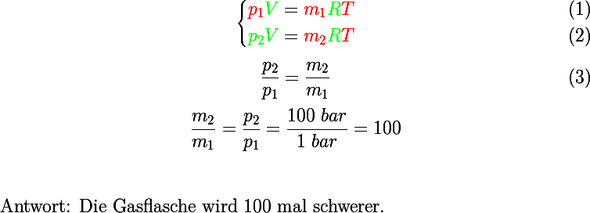
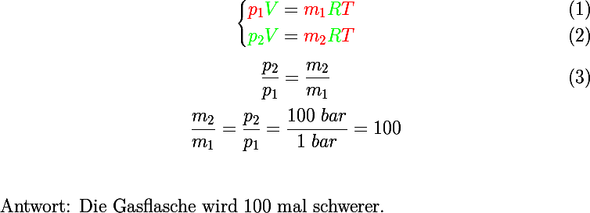
Du hast die Gasgleichung nicht verstanden. Die universelle Gleichung lautet übrigens pv = nRT. Dabei ist n die Stoffmenge in Mol.
Schau dir den Beitrag von Hamburger02 an, so macht man das am Einfachsten
Die Masse ist nicht von der Temperatur abhängig, sondern das Volumen