Ammoniumpuffer - ich versteh das nicht?!
Hi
Ich bin mal wieder am Verzweifeln. Ich will einen Ammoniumpuffer herstellen und habe dafür Ammoniak (25%ig) und Ammoniumchlorid zur Verfügung.
Ich versteh das allgemeine Prinzip ja, aber bei diesem konkreten Fall ...?
Ich würde die Stoffmenge von 2,5 g der Flüssigkeit berechnen. Diesen Wert würde ich mit der molaren Masse von Ammoniumchlorid multiplizieren und hätte die Masse für diesen Stoff. Mit dieser würde ich dann eine 10 ml - Lösung mit Wasser und Ammoniumchlorid herstellen. Dann würde ich diese 10 ml mit 10 ml Ammoniak mischen. Fertig ist der Puffer.
Ist das erstmal so korrekt?
Danke.
2 Antworten
Wenn Du einen Ammoniak/Ammoniumchlorid-Puffer machen willst, mußt Du Dich entscheiden, bei welchem pH er überhaupt puffern soll. Grob gesagt ist der bei pH 9 effizient.
Wenn Du weißt, welchen pH Du willst, dann nimmst Du die Hendersen–Hasselbach-Gleichung und rechnest Dir das notwendige Verháltnis NH₄Cl zu NH₃ aus.
Dann mußt Du Dich noch entscheiden, wie stark der Puffer werden soll, weil nur das Verhältnis zwischen den beiden festgelegt ist. Und dann flst Du ein und fertig.
Dann sag mir, was Du willst, und ich kann es Dir ausrechnen. Also wie konzentriert soll der Puffer sein, und welchen pH soll er haben?
Von der Konzentration wird nichts erwähnt. Auch von einem bestimmten pH-Wert ist nicht die Rede. Ich sage aber mal einfach einen pH-Wert von ungefähr 9. Der Ammoniak ist auf 25% verdünnt.
Ich bedanke mich schon vorab. Ich finde es extrem nervig, dass ich Sachen bekomme, die ich zuvor noch nie gelerht worden bin.
Ich sage aber mal einfach einen pH-Wert von ungefähr 9. Der Ammoniak ist auf 25% verdünnt.
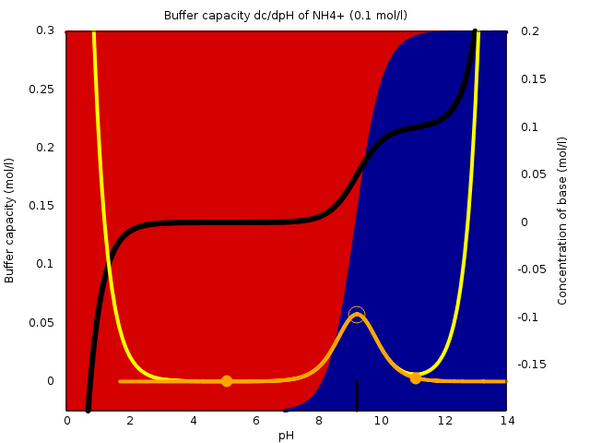
Ich mach das jetzt als neue Antwort. Nicht weil ich Punkte schinden will, sondern weil ich eine Graphik anhänge und das bei Kommentaren nicht klappt.
Je nach pH-Wert liegt Ammoniak als NH₃ (im Basischen) oder NH₄+ (im Sauren). Über den größten Teil des pH-Bereiches hast Du praktisch 100% von einem und null Prozent vom anderen. Nur in der Umgebung des pKa-Wertes (der beträgt 9.25) liegt beides in merklichen Konzentrationen vor. Die angehängte Graphik zeigt das: Links (sauer) siehst Du 100% rot (=Ammonium), rechts 100% blau (NH3), und der Übergang ist relativ scharf, eben bei pH=9.25.
Genau in diesem Bereich kann die Lösung puffern, weil beide Spezies in merklichen Mengen vorliegen. Gibst Du ein bißchen Säure zu, dann frißt die NH₃ auf, und der pH-Wert ändert sich nicht viel; gibst Du Base zu, dann verbraucht das ein bißchen NH₄+, und dem pH=Wert ist das auch ziemlich egal. Man sagt, die Pufferkapazität ist am pKa-Wert maximal (gelbe bzw. orange Kurve).
Mischt man NH₃ und NH₄Cl genau im Verhältnis 1:1, bekommt man eine Lösung, die pH=pKa hat und bei der die Pufferkapazität maximal ist (oranger leerer Kreis). Reines NH₃ bzw. NH₄Cl haben dagegen stark abweichende pH-Wert und puffern nicht (orange Vollkreise).
Die Henderson–Hasselbach-Gleichung sagt pH = pKa + lg [ c(NH₃) / c(NH₄Cl) ]
Wenn wir pH=pKa wollen, nehmen wir einfach gleiche Konzentrationen als NH₃ und NH₄Cl, dann ist der Quotient 1 und der Logarithmus davon 0. Sonst müssen wir ein bißchen rechnen, und erhalten für den gewünschten pH=9 die Relation c(NH₃)/c(NH₄Cl) = 10^(–0.25)= 0.56
Wenn wir eine Gesamtkonzentration von 0.1 mol/l wünschen, brauchen wir also 0.0640 mol/l NH₄Cl und 0.0360 mol/l NH₃.
Beim NH₄Cl nehmen wir also auf einen Liter Pufferlösung 0.0640 mol = 3.424 g. Beim Ammoniak müssen es 0.0360 mol sein, das entspricht 0.613 g, oder 2.45 g einer 25%igen Lösung, oder 2.69 ml.
Wichtig sind dabei nur die Verhältnisse. Du kannst die Konzentrationen mit einer fast beliebigen Zahl multiplizieren, ohne daß sich am pH etwas ändert. Allerdings puffert ein verdünnter Puffer nicht so gut wie ein konzentrierter.
(Ich hoffe, ich habe mich nirgendwo verrechnet).
Das Problem ist, dass die besagte Gleichung oder ähnliches in keinster Form irgendwann erwähnt wurde.