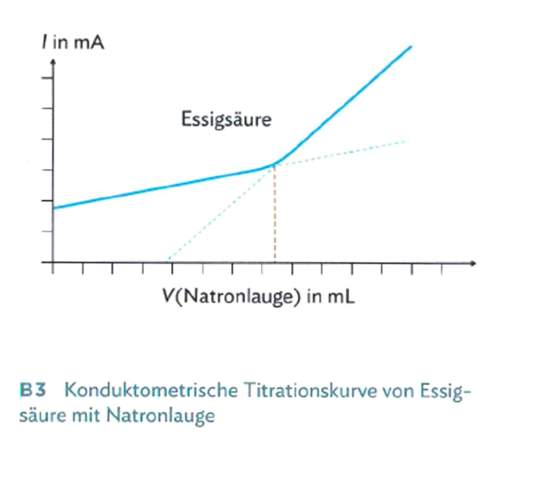
Wieso steigt die Leitfähigkeit vor dem Aquevalenzpunkt?
Wieso steigt die Leitfähigkeit vor dem Äquevalenzpunkt? Ich weiß das es sich um eine schwache Säure hält aber verstehe das Prinzip irgendwie trotzdem nicht. Kann es mir irgendwer schnell erklären?
2 Antworten
Während der Titration wird auf dem Weg zum Äquivalenzpunkt ständig Essigsäure zu Natriumacetat umgesetzt. Essigsäure ist eine schwache Säure und deshalb abhängig vom pH nur teilweise dissoziiert (am Halbäquivalenzpunkt genau zu 50%), aber das Natriumacetat liegt immer zu 100% in Ionenform vor. Also steigt im Verlauf der Titration die Anzahl der Ionen in der Suppe stetig an, und die Leitfähigkeit steigt.
Nach dem Äquivalenzpunkt tritt zwar keine chemische Reaktion mehr ein, aber die zugetropfte NaOH vergrößert immer noch die Ionenanzahl. Weil OH¯ besonders beweglich ist und wesentlich besser leitet als Acetat, steigt die Leitfähigkeit sogar stärker an als vor dem Äquivalenzpunkt.
Es tut mir leid ich verstehe es noch nicht ganz, kannst du es irgendwie Bildlich erklären?
Die nicht dissoziierte Säure trägt nicht zur Leitfähigkeit bei. Erst wenn sie deprotoniert wurde. Beim Titrieren kommt Lauge dazu, die sowieso gut leitet. Also leitet die Lösung um so besser, je mehr Lauge, bzw. deprotonierte Säure drin ist.