Wie entsteht die Anziehung zwischen beiden Atomen?
Ab Punkt 2 zieht der Kern des einen Atoms die Elektronenwolke des anderen an.
Aber dort sind doch von beiden neutralen Atomen die Orbitale noch symmetrisch, dadurch sollte der Kern des einen durch seine eigene Elektronenwolke kein e Feld nach außen erzeugen, wie auch das andere.
Liegt das also bei Punkt zwei noch an der Londoner Dispersionskraft, also dass durch kurzzeitige Änderung der Elektronendichte beim einen Atom ein Dipol entsteht, der beim anderen ebenfalls einen induziert und sich somit beim einen das Elektron auf der Rückseite mehr aufhält, während der Kern die andere Elektronenwolke an sich ziehen kann? Warum steht das dann nicht dabei?
2 Antworten
Wie lautete das Coulombgesetz nochmal?
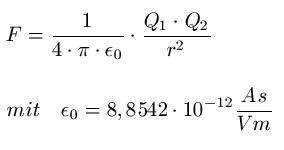
Bringen wir zwei Atome nah genug aneinander, so wirkt der das elektrische Feld des positiv geladenen Kerns stärker. Es hängt also vom Abstand ab. Wie sich aus der Gleichung herauslesen lässt fällt die Feldstärke Quadratisch mit dem Abstand. Es spielt also keine Rolle ob die Gesamtladung 0 ist, da es genauso viele Elektronen wie Protonen gibt.
ist das Elektron nah genug dran wirkt auch das elektrische Feld wieder. Für die Erklärung braucht es nicht besonders kompliziert sein, da reicht sogar das Schalenmodell aus.
Die Frage dir wir uns stellen ist also wie viele Valenzelektronen haben wir? Denn diese befinden sich im Modell auf einem Identischen Abstand zum Kern. Je mehr Valenzelektronen wir haben, desto größer ist natürlich auch deren abstoßende Wirkung aufeinander. So kann man sich das schon einfach grob herleiten wie es sein kann, dass diese Anziehung trotz ausgeglichener Gesamtladung existiert, denn die elektrische Feldstärke E ist vom Abstand des Atomkerns zum Elektron abhängig und nicht direkt von der Anzahl der Gesamtladung.
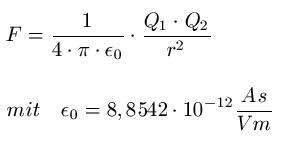
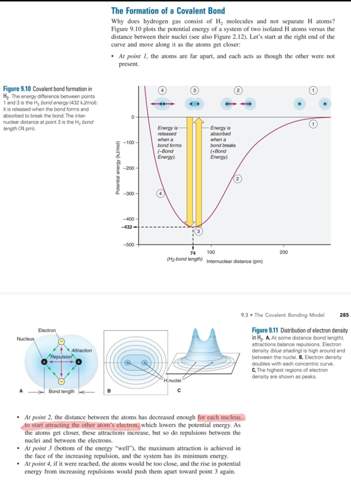
Die beiden Atome ziehen sich an, da die Elektronenwolke den Kern nicht komplett abschirmen kann. Wenn man die Elektronen als sich bewegende Teilchen ansieht, dann können sie auch mal auf der anderen Seite des Kerns sein. Außerdem "spürt" der Kern, der möglichst die Oktett-Regel (hier Duplett) erfüllen möchte, die Möglichkeit, eine kovalente Bindung aufzubauen. Dieser Zustand ist energetisch günstiger und somit fallen die Atome in dieses Energietal.
Sollte Schritt zwei dann nicht trotzdem erstmal so aussehen?: https://imgur.com/a/xBHumuJ
Und erst wenn sie immer näher kommen gehen beide Elektronen zwischen beide Kerne
Das sind alles fließende Übergänge. Zuerst werden die Atome polarisiert, dann gehen die Elektronen zwischen die Kerne und schließlich bildet sich die Bindung aus.
Also ist das ein Mix aus "Londoner Dispersionskraft" und "die Wellenfunktionen fangen aus so weiter Distanz schon langsam an sich zu addieren und die Elektronen halten sich mehr zwischen den Kernen auf was zu Asymmetrie und noch mehr Anziehung der Elektronen zu den anderen Kernen führt"?