Ich schreib gerade einen Aufsatz über die Elektrolyse von Wasser. Vielleicht gibt es hier ein paar Chemieexperten die einmal drüberschauen wollen und vielleicht etwas hinzufügen oder berichtigen wollen
Soweit bin ich bisher
Definition Wasserelektrolyse
Die Wasserelektrolyse von Wasser zu Wasserstoff ist eine chemische exoterme Reaktion die mithilfe von elektrischer Spannung Wasser und Sauerstoff im Wasser voneinander trennt.
Versuchsbeschreibung der Wasserlektrolyse:
Materialen: Verdünnte Schwefelsäure ,Gleichspannungsquelle,Anschlusskabel und Krokodilsklemmen,U-Rohr,Stativ,2 Graphitelektroden mit Gummistopfen
Aufbau
- Schraube das U-Rohr an das Stativ und kippe die Verdünnte Schwefelsäure rein bis es zu zwei Drittel voll ist.
- Befestige nun die Elektroden an den beiden Ausgängen der Röhre. Stopfe dann mit den Gummistopfen die Rohrenden luftdicht zu.
- Verbinde jetzt mithilfe der Anschlusskabel und den Krokodilsklemmen die Elektroden mit der Spannungsquelle.
Durchführung
Nun schalten wir den Gleichstrom bei 6-10 Volt( Je nachdem wie stark die Schwefelsäure verdünnt ist) bei mindestens 10 Minuten ein und lassen die Mischung elektrolysieren.
Chemischer Ablauf während der Elektrolyse
Während der Gleichstrom angeschaltet ist spielen sich zwei Teilreaktionen ab. Eine Oxidation und eine Reduktion.
Die Oxidation passiert bei der Anode also der Elektrode die am Pluspol angeschlossen ist. Dorthin gehen die negativ geladenen Hydroxid-Ionen. Mehrere dieser Ionen verbinden sich mit der Abgabe von Elektronen miteinander. Es entsteht reines Wasser und Sauerstoff der nach oben entweicht.
Die Reduktion läuft bei der am Minuspol angeschlossenen Elektrode also der Kathode ab. Dorthin gehen die die positiv geladenen Oxonium-Ionen. Hier bekommen sie ein Elektron das durch den Stromfluss vom Minuspol kommt. Es entsteht neutrales Wasser und ein Wasserstoffatom was sich mit einem anderen zu Wasserstoff verbindet. Dieser steigt ebenfalls nach oben.
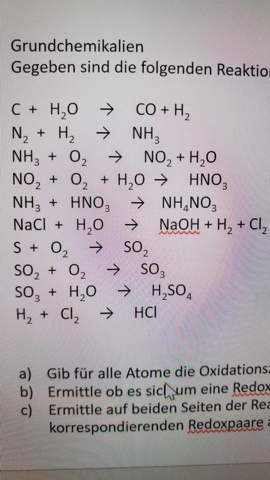
Könntest du mir bitte evtl. bei den anderen auch noch helfen? Vielen Dank!